Содержание
- Распространенность панкреатита
- Причины панкреатита
- Патогенез панкреатита
- Степени тяжести панкреатита
- Диагностика панкреатита
- Лечение панкреатита
- Исходы при панкреатите
- Ключевые моменты
Острый панкреатит — широко распространенное заболевание, обычно со среднетяжелым и тяжелым течением. Тяжелый острый панкреатит — жизнеугрожающее заболевание, которое может потребовать интенсивной поддержки, особенно в начальный воспалительный период ССВР, когда могут быть необходимы массивная инфузионная терапия, респираторная, сердечно-сосудистая, почечная и питательная поддержка. У пациента с нарастающими признаками ССВР после второй или третьей недели заболевания следует заподозрить переход тяжелого острого панкреатита со стерильным некрозом в инфицированный некроз. Для диагностики инфицирования поджелудочной железы следует выполнить аспирацию тонкой иглой. Санация инфицированных некрозов поджелудочной железы необходима, но единого мнения относительно методики ее выполнения нет, вероятно, лучшим подходом будет «постепенное нарастание». Несмотря на то, что тяжелый острый панкреатит — жизнеугрожагощее заболевание, в центрах, имеющих опыт лечения этого сложного синдрома, выживает около 90% всех пациентов.
Термин «острый панкреатит» описывает широкий спектр заболеваний, варьирующих от легкой отечной формы острого панкреатита до тяжелого острого некротизирующего панкреатита — панкреонекроза. Это заболевание ЖКТ чаще всего становится причиной госпитализации в Соединенных Штатах, и связанные с ним расходы составляют более 2 млрд долларов в год. Легкая форма панкреатита может разрешиться спонтанно, обычно в течение 3-4 дней, и не сопровождается сколько-нибудь существенной органной дисфункцией; летальность менее 1%. Пациентам с этой формой острого панкреатита редко требуется лечение в условиях отделения интенсивной терапии (ОРИТ) или хирургическое. Хотя у большей части (80%) пациентов с острым панкреатитом он протекает в легкой форме, в 10-15% случаев развивается синдром системной воспалительной реакции (ССВР) с фульминантный клиническим течением, приводящим к панкреонекрозу и полиорганной недостаточности. Летальность при тяжелом панкреатите достигает 15-30%, тогда как летальность среди всех пациентов с острым панкреатитом менее 5%.
Для первых 7-14 дней течения этого заболевания характерна ССВР, ведущая к дисфункции конечных органов. Происходит выброс медиаторов воспаления в системную циркуляцию и у пациентов манифестирует симптоматика сердечно-легочной и почечной недостаточности. На этой ранней стадии инфицирование поджелудочной железы не типично, однако бактериемия и пневмония выявляются в среднем уже на 7 день. Попытки изменить течение заболевания применением ингибиторов протеаз, октреотида или антагонистов рецепторов тромбоцит-активирующего фактора оказались безуспешными.
С 1980-х гг. летальность и осложнения при остром панкреатите существенно уменьшились. В большинстве случаев смерть пациентов с панкреатитом становится следствием инфекции. Инфицирование некротизированной поджелудочной железы (и прилежащих тканей) обычно развивается на второй-третьей неделе заболевания, и, по литературным данным, имеет место у 40-70% пациентов с панкреонекрозом. Инфицированный некроз является наиболее важным фактором риска смерти вторичной панкреонекрозу. Профилактика, диагностика и оптимальное лечение инфекции при тяжелом остром панкреатите критически важны для улучшения исходов у пациентов с этим заболеванием.
Распространенность панкреатита
Причины панкреатита
Злоупотребление алкоголем обычно становится причиной острого панкреатита приблизительно в 30% случаев. К нечастым причинам панкреатита относятся лекарственные реакции (обычно идиосинкразия), ампулярные и панкреатические опухоли, гипертриглицеридемия, гиперкальциемия, кисты холедоха, травма (включая острый панкреатит после эндоскопической ретроградной холангиопанкреатографии), а также инфекция и паразитарные заболевания. Редкие причины панкреатита включают укусы некоторых видов пауков, скорпионов и ящерицы аризонского ядозуба (Gila monster). Неустановленные причины панкреатита называют идиопатическими.
Патогенез панкреатита

Трипсин активирует множество пищеварительных проферментов и воспалительные клетки (через PAR-2). Активность трипсина в поджелудочной железе контролирует главным образом ингибитор панкреатической секреции трипсина (PSTI). Когда в поджелудочной железе трипсиноген активирован в трипсин, PSTI немедленно связывается с трипсином для предупреждения дальнейшей активации панкреатических ферментов.
Независимо от причин, панкреатит является воспалительным процессом, способным вызывать ССВР. Внутриклеточные механизмы, вызывающие и ускоряющие развитие панкреатита, детально не установлены. Три фенотипических реакции происходят в ацинарных клетках на ранних стадиях острого панкреатита:
- изменения секреции;
- внутриклеточная активация протеаз;
- выработка медиаторов воспаления.
Вскоре после соответствующей стимуляции, продукция секреции из апикальных клеток попадает в панкреатический проток. Этот процесс вызывает внеклеточное слияние гранул зимогена с апикальной плазменной мембраной; гранулы не сливаются с базолатеральной мембраной. Однако во время острого панкреатита происходит:
- заметное снижение апикальной секреции из ацинарных клеток;
- нарушение межклеточного барьера в панкреатическом протоке, с проникновением его содержимого в межклеточное пространство;
- перенаправление продукта секреции гранул зимогена в базолатеральные зоны ацинарных клеток.
Таким образом, первым этапом развития острого панкреатита считается несвоевременная активация протеолитического фермента, трипсина. Активации трипсиногена способствуют его катионные мутации (PRSS1+), активный трипсин, высокая концентрация ионов кальция и низкая pH. Уровни кальция регулируют в частности чувствительные к кальцию рецепторы (CARS), эту регуляцию нарушает этанол. Если трипсин активируется внутри поджелудочной железы, развивается воспаление, и это выключает регуляцию гена Kazal тип 1 (SPINK1), ингибитора протеазы серина, который дополнительно блокирует активацию трипсиногена. Трипсин также активирует клетки через трипсиновые рецепторы, которые есть в ацинарных и протоковых клетках, известные как протеаз-активируемые рецепторы 2 (PAR-2). Активность трипсина в поджелудочной железе в основном контролирует ингибитор панкреатической секреции трипсина (PSTI), который также называют SPINK1. PSTI, мощный естественный ингибитор трипсина, синтезируют ацинарные клетки поджелудочной железы. Когда трипсиноген расщепляется для высвобождения трипсина в поджелудочной железе, PSTI немедленно связывается с ферментом для предупреждения дальнейшей активации дополнительных панкреатических ферментов. PSTI также блокирует дальнейшую активацию панкреатических клеток через трипсиновый рецептор, PAR-2.
Несколько дополнительных защитных систем предупреждают самопереваривание поджелудочной железы трипсином, и генетическая выраженность этих систем может влиять на риск развития острого панкреатита или изменения тяжести течения заболевания, если оно уже есть. Есть сообщения о мутациях в SPINK1, N34S у людей с семейным панкреатитом, у детей с хроническим идиопатическим панкреатитом и у 2% в контрольной популяции. Поскольку мутации SPINK1 встречаются значительно чаще, чем панкреатит, они, по-видимому, скорее модифицируют заболевание, чем являются его причинным фактором.
Степени тяжести панкреатита

Прогноз тяжести течения заболевания во время поступления затруднен. Было предложено несколько прогностических систем баллов, с клиническими, лабораторными и рентгенологическими критериями, но ни одна из них не обладает высокой чувствительностью, специфичностью, позитивной прогностической ценностью или негативным вероятностным отношением, и зачастую клиническая оценка остается жизненно важной для выявления пациента с тяжелым заболеванием. Критерии Рэнсона, шкала Imrie (Глазго), баллы шкал Acute Physiologic and Chronic Health Evaluation (APACHE) II и III, упрощенный показатель физиологической остроты и индекс компьютерной томографии (КТ) Бальтазара — наиболее популярные системы оценки, часто применяемые для определения необходимости госпитализации в ОРИТ. Критерии Рэнсона основаны на 11 прогностических показателях имеющихся при поступлении и через 48 часов после. Мета-анализ исследований, в которых применялись критерии Рэнсона для прогнозирования тяжести острого панкреатита (SAP), показал, что они обладают: чувствительностью — 74%; специфичностью — 77%; позитивной — прогностической ценностью — 49% и негативной прогностической ценностью — 91%.
Многие учреждения рутинно применяют систему баллов APACHE для всех пациентов, направленных в ОРИТ. У пациентов, имеющих более 8 баллов по SAP и APACHE II, течение заболевания тяжелое и вероятно развитие органной недостаточности. Ключевые статистические параметры, связанные с баллами по APACHE II выше 7 и прогнозом SAP, таковы: чувствительность — 65%; специфичность — 76%; позитивная прогностическая ценность — 43% и негативная прогностическая ценность — 89%. В индексе КТ по Бальтазару для прогнозирования исхода используются данные о скоплениях жидкости и количеству некроза поджелудочной железы. Международная группа экспертов пришла к заключению о необходимости выделить и определить дополнительную группу пациентов: с острым панкреатитом средней тяжести (MSAP). В 2012 Talukdar и соавторы выполнили проспективное исследование, в котором пациенты были классифицированы в группы, имеющие SAP, MSAP и легкий острый панкреатит. В группе MSAP частота необходимости во вмешательствах и длительность госпитализации была сопоставима с таковыми группы SAP, однако лечение в ОИТ потребовалось только 12% пациентов и никто из них не умер. Это можно считать разделяющим признаком, наличие которого следует идентифицировать как можно раньше для определения прогноза .
Несколько биомаркеров плазмы были исследованы как возможные прогностические критерии тяжести острого панкреатита. Уровни С-реактивного протеина (CRP) выше 150 мг/л сопровождали панкреонекроз (чувствительность и специфичность 80%); однако CRP повышается после 48 часов латентного периода, что ограничивает его применение для раннего прогнозирования заболевания. Панкреатическую дисфункцию могут прогнозировать уровни прокальцитонина выше 3,8 нг/мл (чувствительность — 79%, специфичность — 93%).
Перечисленные системы баллов помогают количественно определить степень тяжести панкреатита, но принципиально важно, чтобы клиницисты идентифицировали пациентов по угрожающей или существующей органной недостаточности. Пациенты с признаками ССВР находятся в зоне особого риска дальнейшего развития органной дисфункции.
Атлантская классификация острого панкреатита впервые была опубликована в 1993 году и разделяла панкреатиты на разные категории в попытке определить их степень тяжести. Она была пересмотрена в 2012 году, и теперь пациентов разделяют на:
- интерстициальный отечный панкреатит (диффузное воспаление поджелудочной железы и окружающих тканей),
- некротизирующий панкреатит (некроз поджелудочной железы).
Атлантская классификация острого панкреатита также разделяет проявления на:
- легкий острый панкреатит (органная недостаточность, локальные или системные осложнения отсутствуют),
- острый панкреатит средней тяжести (органная недостаточность разрешается в течении 48 часов, локальные или системные осложнения без персистирующей органной недостаточности),
- тяжелый острый панкреатит (персистирующая органная недостаточность).
Диагностика панкреатита
Клиника и симптомы
Диагноз острый панкреатит можно предположить у пациента с болями и напряжением в верхних отделах живота, тошнотой, рвотой и гиперамилаземией или гиперлипаземией. Эти признаки не специфичны и возможны при других острых интраабдоминальных состояниях. Симптомы Куллена и Грея Тернера (кровоподтеки в параумбиликальной и боковых поверхностях брюшной стенки соответственно) редки и возможны при забрюшинном кровоизлиянии любой этиологии.
Лабораторная диагностика
Хотя гиперамилаземия типична для пациентов с острым панкреатитом, в 10-20% всех случаев уровень амилазы в крови может быть нормальным, главным образом в случаях вторичных гиперлипидемии, обострению хронического панкреатита и на поздних стадиях заболевания. Преимущества определения амилазы плазмы в том, что оно технически несложно, широко доступно и чувствительно. Однако специфичность ее не высока. При остром панкреатите также возможно повышение уровня липазы в плазме. Он повышается в период 4-8 часов, достигает пика к 24 часам и возвращается к норме через 8-14 дней. Основное достоинство определения липазы плазмы как диагностического теста — великолепная чувствительность при остром алкогольном панкреатите. Она также весьма полезна, когда пациент поступает через несколько дней после начала заболевания, так как остается повышенной длительнее, чем амилаза. Одновременное исследование уровней амилазы и липазы не повышает точность диагностики острого панкреатита.
Если причина панкреатита не ясна и есть подозрение на липидемию, следует определить уровни триглицеридов плазмы. Уровни триглицеридов в кровотоке выше 1000 мг/ дл (11,3 ммоль/л) считаются способными провоцировать панкреатит, хотя должным образом это пока не доказано.
Для диагностики острого панкреатита можно использовать трипсиноген-2. Его измеряют в моче, диагностическими полосками (мочевой трипсиноген-2 — UT-2), с ориентиром на пороговое значение 50 мкг/л. Есть данные о его чувствительности и специфичности 80 и 92% соответственно, при выявлении пациентов с острым панкреатитом.
Инструментальная диагностика
Ультразвуковое исследование (УЗИ)
Классическое ультразвуковое исследование
Ультразвуковое исследование (УЗИ) следует рассматривать как первый тест для всех пациентов с панкреатитом, особенно при подозрении на желчнокаменную болезнь или билиарное заболевание. Его можно выполнить у кровати пациента, без седации, что делает его важным инструментом обследования нестабильного пациента. В настоящее время УЗИ не применяется для определения степени тяжести панкреатита или степени некроза железы; однако УЗИ с контрастированием может изменить эту ситуацию. УЗИ с контрастированием обладает чувствительностью и специфичностью 82 и 89%, соответственно.
Эндоскопическое ультразвуковое исследование
Эндоскопическое ультразвуковое исследование (ЭУЗИ) сочетает ультразвуковое и эндоскопическое исследование. Оно менее инвазивно, чем эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) и есть данные, что оно клинически полезно для диагностики острого панкреатита и холедохолитиаза. Эндоскопическое ультразвуковое исследование может быть полезно в случаях, когда при помощи КТ и УЗИ камни в общем желчном протоке увидеть не удалось. ЭУЗИ может быть также полезно для выявления пациентов, которым показана ЭРХПГ и экстракция камня на ранних этапах. Petrov с соавторами выполнили обзор исследований пациентов, рандомизированных на ЭРХПГ под ЭУЗИ наведением (n = 213) и только ЭРХПГ (n = 210). Авторы показали, что ЭРХПГ удалось избежать у 67,1% пациентов, у которых ЭУЗИ не выявило желчных камней. Применение ЭУЗИ существенно снижает риск осложнений в целом (относительный риск (ОР) 0,35, 95% доверительный интервал (ДИ) 0,20-0,62) и пост-ЭРХПГ панкреатита (ОР 0,21, 95% ДИ 0,06-0,83). Дополнительное преимущество эндоскопического УЗИ в том, что его можно выполнять беременным, пациентам с металлическими имплантами и тем, кто недостаточно стабилен для транспортировки за пределы ОРИТ.
Компьютерная томография (КТ)
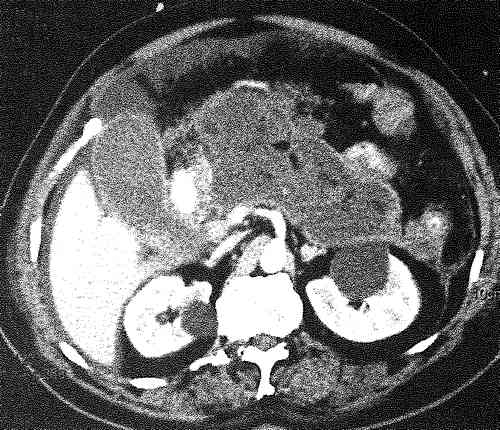
КТ с контрастированием считается золотым стандартом диагностики панкреонекроза и перипанкреатических скоплений жидкости, а также уточнения градации острого панкреатита. КТ определяет некроз как фокальные или диффузные зоны пониженного накопления контраста в панкреатической паренхиме (< 50 единиц Хаунсфилда). Точность этого теста превышает 90%. Возможные КТ-находки при остром панкреатите включают интерстициальный отек, нечеткость контура поджелудочной железы с облитерацией перипанкреатической жировой клетчатки, гетерогенный вид поджелудочной железы с зонами пониженной плотности и плохо очерченные скопления жидкости. Индекс Бальтазара варьирует от 0 до 10 л получается в результате сложения баллов, связанных с распространенностью воспалительного процесса и объема некроза поджелудочной железы. Хотя данные КТ коррелируют с клиническим течением и степенью тяжести заболевания у пациентов с острым панкреатитом, в этом исследовании нет необходимости при легкой его форме. Выполнение КТ при панкреатите в ранние сроки может ухудшить панкреатическую микроциркуляцию и привести к нефропатии в результате введения контраста. Таким образом, до 72 часов с момента развития заболевания КТ следует применять только пациентам, диагноз которых вызывает сомнения.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ)
ЭРХПГ — эффективное средство лечения камней общего желчного протока. ЭРХПГ не показана для лечения панкреатита легкой формы или не желчнокаменной этиологии, и в целом ее применение у пациентов с острым панкреатитом остается предметом дискуссии. Ее в основном применяют при лечении пациентов с билиарным панкреатитом, билиарной обструкцией или холангитом. Остается противоречивой и роль ЭРХПГ при лечении пациентов с билиарным панкреатитом, но без обструкции желчного протока.
Магниторезонансная холангиопанкреатография
Магниторезонансная томография (МРТ) и МРТ желчевыводящих путей — неинвазивные визуализирующие методики, эффективно выявляющие патологию протока и паренхимы поджелудочной железы. У МРТ есть несколько преимуществ перед КТ: нет риска, связанного с облучением, она может выявлять нарушения протока и может помочь определить причину острого панкреатита. Без введения гадолиния она может отличить нормальную паренхиму поджелудочной железы от отеков и некрозов, а также плотную ткань от скоплений жидкости. МРТ желчевыводящих путей можно выполнить, когда ЭРХПГ не удалась или невозможна, но недостаток МРТ в том, что это только диагностическая процедура, после которой могут потребоваться другие лечебные вмешательства.
Хотя КТ с контрастированием считается золотым стандартом, результаты нескольких исследований дают основания полагать, что в сравнении с ней МРТ выигрывает при диагностике и определении степени тяжести острого панкреатита. Основное преимущество МРТ желчевыводящих путей при SAP в том, что она не требует применения йодированных контрастных веществ и, таким образом, снижает риск острой почечной дисфункции у пациентов в критических состояниях. Перистальтика кишечника, артефакты движения сосудов, воздух в ЖКТ и наличие металлических клипс могут снизить качество изображений, получаемых при МРТ желчевыводящих путей. Одним из недостатков МРТ и МРТ желчевыводящих путей является более длительное время, необходимое для получения изображений, чем при КТ.
Лечение панкреатита
Общее поддерживающее лечение панкреатита
Мониторинг и инфузионная терапия при панкреатите
В нескольких публикациях высказывается мнение, что пациентов с тяжелым острым панкреатитом следует лечить в ОИТ, предпочтительно силами специальной бригады. Независимо от причин и тяжести острого панкреатита ключевым компонентом первичного лечения панкреатита является восполнение внутрисосудистого объема. Потери жидкости в виде секвестрации во внесосудистое и внеклеточное пространство могут достигать трети всего объема плазмы. Быстрое восстановление и поддержание внутрисосудистого объема жизненно важны, так как гиповолемия и шок вероятно основные причины высокой частоты острой почечной недостаточности среди пациентов с тяжелым острым панкреатитом.
Доказано, что агрессивная инфузионная очень важна при лечении пациентов с острым панкреатитом, особенно в первые 24 часа. Warndorf и соавторы выполнили ретроспективное исследование, в котором ранняя инфузионная терапия снижала частоту ССВР (введение трети всего 72-часового объема жидкости в течении первых 24 часов). Однако избыточная и неадекватная инфузионная терапия также может стать причиной значительной летальности и осложнений, включая дыхательную недостаточность и абдоминальный компартментный синдром (АКС).
Дисфункция одного или нескольких органов типична, в связи с чем мониторирование состояния сердечно-сосудистой и дыхательной систем жизненно важно.
Адекватная доставка кислорода к тканям и предупреждение ишемии внутренних органов также важны для недопущения дальнейшей органной дисфункции. Могут потребоваться вазоактивные препараты, но их следует применять только после адекватной инфузионной терапии.
Даже при наличии системных признаков адекватной инфузионной терапии, локальное воспаление в поджелудочной железе может продолжаться, с выделением цитотоксических медиаторов. Лечение ингибиторами протеаз было успешным в экспериментальных моделях острого панкреатита и в Японии применяется в виде постоянной артериальной инфузии. Было выполнено клиническое исследование, сравнивающее постоянную региональную инфузию ингибитора протеаз, габексата мезилата плюс антибиотик с лечением без инфузии. Лечение с инфузией сокращало длительность боли в животе и длительность ССВР, сокращало длительность госпитализации и снижало уровни нескольких маркеров воспаления в кровотоке. В других исследованиях эти многообещающие результаты воспроизвести не удалось. Yasunaga и коллеги не нашли существенной разницы в летальности (1% против 1,2%, р = 0,789) или средней длительности госпитализации (10 дней против 10 дней, р = 0,160) между пациентами, получавшими лечение габексата мезилатом или без него. Мета-анализ, опубликованный в 2012 году не нашел разницы в летальности пациентов, получавших лечение ингибиторами протеаз при сравнении с теми, кто такого лечения не получал.
Несмотря на значительный интерес, который вызвало снижение продукции цитокинов при назначении анти-TNF антител и антагонистов рецепторов IL-1, продемонстрировать преимущества этого подхода не удалось.
Дыхательная недостаточность
Дыхательная недостаточность есть основной компонент синдрома полиорганной недостаточности, вторичной острому панкреатиту. У этих пациентов может развиться острый респираторный дистресс-синдром (ОРДС) и потребоваться искусственная вентиляция легких. Хотя механизм развития ОРДС в результате панкреатита ясен не вполне, есть предположение, что фосфолипаза А2, вырабатываемая поджелудочной железой, попадая в кровоток, разрушает депалмитоилхолин (компонент сурфактанта).
Лечение дыхательной недостаточности
Пациентов с тяжелым острым панкреатитом необходимо пристально мониторировать на гипоксическую и/или гиперкапническую дыхательную недостаточность. Почти всегда требуется вспомогательная оксигенотерапия, а нередко и механическая вентиляция. У тщательно подобранной категории пациентов неинвазивная вентиляция с положительным давлением (НИВЛ) помогает обойтись без интубации трахеи. Тяжелый острый панкреатит часто сопровождается значительным вздутием живота, снижающим функциональную остаточную емкость легких. Лечение острого повреждения легких и ОРДС при тяжелом остром панкреатите не отличается от лечения этих состояний при других первичных проблемах (например, сепсис).
Обезболивание при панкреатите
Обезболивание пациентов с тяжелым острым панкреатитом имеет не только гуманное значение, но также может улучшить течение легочной дисфункции. Результаты исследований за пределами Соединенных Штатов показали более высокую эффективность бупренорфина при сравнении с прокаином, без сокращения сфинктера Одди. В одном клиническом исследовании, сравнивавшем метамизол (анальгин) и морфин, различий в анальгетическом действии найдено не было. Хотя внутривенные наркотики полезны и эффективны, следует рассматривать также применение эпидуральной анальгезии местными анестетиками.
Специфическое лечение панкреатите
Питание при панкреатите
Традиционно пациентам с острым панкреатитом жидкости и нутриенты вводили внутривенно, избегая энтерального питания с целью дать «отдых» воспаленной поджелудочной железе и предупредить стимуляцию ее экзокринной функции с выделением протеолитических ферментов. Тем не менее большинство пациентов с легким течением острого панкреатита могут начинать пероральное питание через несколько дней после начала заболевания и нутритивная поддержка им не нужна.
В прошлом, первым выбором обеспечения питания пациентов с острым панкреатитом было полное парентеральное питание (TPN). Это дорого, может повысить риск сепсиса или метаболических расстройств, и сопровождалось изменениями барьерной функции кишечника. Мета-анализ нескольких клинических исследований, сравнивавших энтеральное и парентеральное питание у пациентам с острым панкреатитом, показал, что энтеральное питание снижает частоту инфекций, частоту необходимости в хирургических вмешательствах и уменьшает длительность госпитализации. Кохрановская Группа выполнила аналогичный обзор 8 клинических исследований, сравнивавших энтеральное и парентеральное питание, и пришла к заключению, что относительный риск (ОР) смерти при энтеральном питании был 0,50 (95% ДИ 0,28-0,91), ОР полиорганной недостаточности был 0,55 (95% ДИ 0,37-0,81), ОР системной инфекции был 0,39 (95% ДИ 0,23-0,65), ОР хирургического вмешательства был 0,44 (95% ДИ 0,29-0,67), ОР локальных септических осложнений был 0,74 (95% ДИ 0,40-1,35) и ОР других локальных осложнений был 0,70 (95% ДИ 0,43-1,13). Средняя длительность госпитализации снизилась на 2,37 дня (95% ДИ 7,18-2,44) в группе энтерального питания.
Если установлен назодуоденальный или назоеюнальный зонд, необходима осторожность при выполнении манипуляций через двенадцатиперстную кишку вслепую, так как у пациентов с острым панкреатитом она часто смещена, что повышает риск перфорации. В мета-анализе трех рандомизированных контролируемых клинических исследований, Chang и соавторы сравнили назогастральное и назоеюнальное питание пациентов панкреатитом. Различий между этими группами по летальности (ОР = 0,69, Р = 0,25), аспирации в трахею (ОР = 0,46, Р = 0,20), диарее (ОР = 1,43, Р = 0,43) и усилению боли (ОР = 0,94, Р = 0,90) найдено не было. Это дает основания полагать, что назогастральное питание было не хуже назоеюнального. Вспомогательное TPN может быть необходимо в случаях, когда нутритивные потребности не удается обеспечить только энтерально, или энтеральный доступ невозможен. Илеус не является абсолютным противопоказанием к энтеральному питанию, и большинство пациентов могут переносить его продолжение — с меньшей скоростью.
У пациентов с тяжелым острым панкреатитом расход энергии в покое широко варьирует, в зависимости от выраженности регионального воспалительного процесса и наличия дополнительных осложнений, особенно инфекции. Инфекция может повысить расход энергии на 5-20%, но избыточного кормления следует избегать, следовать рекомендациям по нутритивной поддержке и контролировать уровень глюкозы. Уровни триглицеридов следует мониторировать и не допускать их повышения выше нормальных, однако назначение липидов безопасно и приемлемо, если не доказана причинная связь между инфузией экзогенных жиров и развитием панкреатита.
Время возобновления орального кормления следует основывать на клиническом суждении. Задержка с нутритивной поддержкой сопровождается повышением частоты инфицированного некроза/скоплений жидкости, дыхательной недостаточности и необходимости госпитализации в ОРИТ.
Антибиотикопрофилактика
Есть несколько путей доступа микроорганизмов к некротизирующейся поджелудочной железе и окружающим ее тканям, наиболее вероятный — бактериальная транслокация из толстого кишечника. Несостоятельность кишечного барьера позволяет бактериям и дрожжевым грибкам проникать из просвета кишки в асцитическую жидкость, мезентериальную лимфу, кровоток и воспаленную поджелудочную железу. Мнение о том, что инфицирование поджелудочной железы при остром панкреатите происходит под действием микроорганизмов кишечника, поддерживает и тот факт, что в большинстве случаев инфицирование поджелудочной железы мономикробно и вызвано грамотрицательными бактериями, по крайней мере если не была предпринята антибиотикопрофилактика. Дополнительные свидетельства в пользу кишечного происхождения инфицирования поджелудочной железы дают результаты клинических исследований селективной деконтаминации кишечника, при которой энтеральное введение плохо абсорбируемых антимикробных препаратов сопровождалось существенным снижением летальности, в основном приписываемое снижению частоты грамотрицательного инфицирования поджелудочной железы. Микроорганизмы могут также попасть в некрозы поджелудочной железы гематогенным путем с инфицированного центрального венозного катетера, через желчевыводящие пути или панкреатический проток из просвета двенадцатиперстной кишки.
Целесообразность применения антибиотикопрофилактики при лечении острого панкреатита дискутируется уже более 50 лет. При поражении некрозом более 30% железы, ее инфицирование развивается более чем у 30% пациентов с острым панкреатитом. Поскольку приблизительно 80% смертей при остром панкреатите связано с инфекционными осложнениями, важно решить, может ли назначение антибиотикопрофилактики снизить частоту локального или отдаленного инфицирования, и летальность/осложнения, связанные с панкреонекрозом.
Есть три клинических исследования, результаты которых поддерживают применение антибиотикопрофилактики при остром панкреатите. Первое выполнили Pederzoli и соавторы, которые рандомизировали 74 пациента на получавших имепенем или плацебо. Частота вторичного инфицирования снизилась с 30% в контрольной группе до 12% в группе имепенема (Р = 0,10). Не было отмечено позитивного влияния на органную недостаточность, летальность или возможность обойтись без хирургического вмешательства. Второе выполнили Sainio и коллеги, которые рандомизировали 60 пациентов на получавших цефуроксим или плацебо. Инфекционные осложнения и летальность оказались более характерными для группы не получавших антибиотикопрофилактику, по сравнению с группой, получавшей цефуроксим (1,8 на пациента против 1 на пациента, Р = 0,10; 7 против 1, Р = 0,03 соответственно). И наконец, Luiten и соавторы, в клиническом исследовании рандомизировали 102 пациента на группы селективной деконтаминации ЖКТ и стандартного лечения. Из 52 пациентов контрольной группы умерли 18 (35%), в группе деконтаминации умерли 11 из 50 пациентов (22%; Р = 0,048).
В других клинических исследованиях применение антибиотикопрофилактики при лечении пациентов с тяжелым острым панкреатитом поддержки не нашло. В исследовании Hart и коллеги, при использовании антибиотикопрофилактики частота экстрапанкреатического инфицирования снизилась (ОР 0,51 95 % ДИ 0,32-0,82). Xu и коллеги также пришли к заключению, что перипанкреатическое инфицирование (ОР 0,69, 95% ДИ 0,48—0,91) экстрапанкреатического инфицирование (ОР 0,66,95 % ДИ 0,48-0,91) снижались при антибиотикопрофилактике. В обоих этих исследованиях разницы по летальности между группами лечения и плацебо найдено не было.
Были попытки вместо внутривенных антибиотиков использовать пробиотики. В недавно опубликованном систематическом обзоре, выполненном Gou и соавторы, были проанализированный 6 клинических исследований, в целом включавших 536 пациентов. Целью было определить полезность лечения пробиотиками. Пробиотики существенно не влияли на общую инфицированность (ОР = 1,09, Р = 0,57), частоту инфекций (ОР = 1,19, Р = 0,47), частоту необходимости операции (ОР = 1,42, Р = 0,71) и длительность госпитализации (ОР = 0,72, Р = 0,25).
Следует ли широко применять антибиотикопрофилактику при этих показаниях — осталось противоречивой темой. Один из наиболее острых вопросов в отношении рутинного применения антибиотикопрофилактики — изменение за последнее десятилетие микробного спектра, в котором уже рутинно высеваются резистентные бактерии и грибковые патогены.
Грибковая инфекция при тяжелом остром панкреатите становится фактором риска осложнений и, возможно, летальности. Профилактика любым антибиотиком широкого спектра может сопровождаться повышением риска инфицирования патогенными грибками или резистентными бактериями. При использовании антибиотиков широкого спектра, профилактическое применение противогрибковых препаратов может быть необходимым. Хотя в некоторых учреждениях профилактическая антибиотикотерапия внутривенно или энтерально применяется рутинно, повсеместное ее применение не может быть рекомендовано без получения данных поддерживающих ее полезность, превышающую риск антибиотикорезистентности, о которой сообщают результаты современных исследований.
Лечение некроза и абсцесса поджелудочной железы
Панкреонекрозом определяется наличием диффузных или локальных зон нежизнеспособной паренхимы поджелудочной железы. Он может быть стерильным или инфицированным. Инфекция развивается приблизительно в 10% всех случаев острого панкреатита, от 30 до 70% случаев — с некрозом. КТ с контрастированием в настоящее время является золотым стандартом для подтверждения наличия не перфузируемой паренхимы поджелудочной железы. Абсцесс поджелудочной железы есть ограниченное внутрибрюшное скопление гноя, обычно близко прилежащее к зоне ее некроза, возникающее как следствие острого панкреатита.
Инфицированный панкреонекроз следует заподозрить у пациентов с острым панкреатитом и клиническими признаками сепсиса, состояние которых поддерживающая терапия не улучшает, или состояние после некоторого улучшения в начале ухудшается снова.
Пациентам с подозрением на инфицированный панкреонекроз следует выполнить КТ с контрастированием или аспирацию тонкой иглой под контролем УЗИ. Такой подход поможет безопасно и надежно отличить стерильный панкреонекроз от инфицированного. Аспирация под контролем УЗИ с посевом и окраской по Граму полученного материала имеет чувствительность 88% и специфичность 90%. Поскольку есть вероятность контаминации стерильного некроза при пункции, она показана только пациентам с признаками сепсиса, состояние которых улучшить не удается или оно ухудшается после улучшения в начале. Ее не следует применять рутинно пациентам с тяжелым острым панкреатитом, состояние которых стабильно. Исследования подтвердили частоту инфекции от 2,8 до 22% в первую неделю и от 28,8 до 55% со второй по четвертую. Срок аспирации тонкой иглой следует основывать на вероятности инфекции, исходя из срока с начала заболевания и текущего клинического состояния пациента. Некоторые авторы не поддерживают практику аспирации иглой, так как они используют антибиотикопрофилактику и не стали бы выполнять «ранних» вмешательств, основанных на результатах посева материала, полученного при аспирации иглой. Они чаще ждут 3-4 недели и, если состояние пациента не улучшается, после этого срока оперируют, независимо от того, доказано ли наличие инфекции.
Лабораторные маркеры инфицирования некроза
Для подтверждения диагноза инфицированного некроза надежного анализа крови не разработано. Концентрации CRP превышающие 120 мг/л ассоциировались с панкреонекрозом. Однако нет корреляции между уровнем CRP в плазме и наличием инфицированного некроза. Было продемонстрировано, что прокальцитонин, состоящий из 116 аминокислот пропептид кальцитонина, является маркером тяжелых бактериальных и грибковых инфекций. В мета-анализе, выполненном Mofidi и соавторами, чувствительность и специфичность прокальцитонина при прогнозировании инфицированного панкреонекроза составили 0,80 и 0,91 соответственно.
Клиницисты должны искать вероятность инфицированного панкреонекроза с целью подбора антибиотиков и других видов лечения. Аспирация иглой — инвазивная методика и может быть источником осложнений, тогда как исследование прокальцитонина неинвазивно, и на его уровень не влияют антибиотики. Клиницисту важно понимать, что повышение прокальцитонина не является специфическим маркером потенциальной инфекции, и если прокальцитонин повышен, необходимо предпринять системный поиск всех возможных источников инфекции. Однако было установлено, что повышение прокальцитонина наиболее выражено у пациентов внутрибрюшной инфекцией — по сравнению с инфекцией дыхательной и мочеполовой систем.
Показания и сроки оперативного вмешательства
Большинство экспертов в настоящее время рекомендуют отложить операцию по поводу панкреонекроза до тех пор, пока не будет выявлена инфекция. Вмешательство может быть отложено до третьей или четвертой недели пребывания в ОРИТ, если состояние пациента остается стабильным. В прошлом существовало представление о том, что ранняя операция может улучшить исход за счет удаления некротических тканей и ослабления стимуляции системного воспаления, но это представление в настоящее время опровергнуто. Перенесение любого инвазивного вмешательства на как можно более поздний срок стало наиболее типичным подходом к лечению пациента с тяжелым острым панкреатитом и панкреонекрозом, так как на ранних стадиях течения заболевания нет четкой демаркации между жизнеспособными и нежизнеспособными тканями поджелудочной железы. Кроме того, жизнеспособные ткани обычно есть даже тогда, когда железа выглядит полностью некротизированной.
Согласно нескольким опубликованным рекомендациям стандартом лечения стерильного некроза является лечение без операции. В отдельных случаях, если состояние пациентов с обширным некрозом не улучшается, и после длительного периода наблюдения (6-8 недель) может потребоваться оперативная санация.
Оперативное лечение панкреонекроза
Несмотря на общее согласие о том, что инфицированный некроз требует дренирования, нет единого мнения о том, как это лучше сделать. Все методы направлены на удаление инфицированных тканей с сохранением основной части железы. У пациентов в очень тяжелом состоянии, с сепсисом, первая цель лечения — дренирование инфицированного материала. Открытая некрэктомия сопряжена с высоким риском осложнений (34-95%) и смерти (11-39%). Хотя открытое лечение инфицированного панкреонекроза все еще остается наиболее распространенной санирующей операцией, все меньше хирургов применяют ее как метод первичного лечения. Подход «постепенного нарастания» заключается в чрескожном дренировании вначале, с последующей минимальной инвазивной некрэктомии при необходимости. У пациентов, получавших такое лечение, была меньше вероятность развития осложнений (40% против 69% соответственно). Кроме того, при «постепенном» подходе реже развивались органная недостаточность (12% против 40%), послеоперационные грыжи (7% против 24%) и впервые диагностированный сахарный диабет (16% против 38%). Это важное клиническое исследование уникально, так как было рандомизированным исследованием хирургического лечения инфицированного некроза, а не серией сообщений о случаях из одного или более учреждений. Находки этого исследования также дают основания полагать, что «постепенный» подход может иметь преимущество более низкого уровня хирургической травмы, с меньшей активацией медиаторов воспаления. Заменит ли «постепенный» подход открытую хирургическую санацию полностью — пока не ясно.
У некоторых пациентов возможно чрескожное дренирование инфицированного некроза, особенно если инфицированный материал не слишком густой или не перегружен некротическими тканями. Дренирование возможно из переднего или забрюшинного доступов, предпочтительно применение катетеров большого диаметра (12-14 F).
В современных исследованиях есть сообщения о применении для дренирования эндоскопического доступа. Для выявления скоплений жидкости применяется эндоскопический ультразвук через стенку желудка. После серии дилатаций, эндоскоп вводят в полость скопления; эндоскопическими средствами выполняют санацию. Для дальнейшей ирригации и доступа в полость ставят дренаж, который выводят через нос.
Развитие минимально инвазивных технологий в настоящее время позволяет использовать несколько новых подходов к дренированию инфицированных материалов при панкреонекрозе, таких например, как видео-ассистированное ретроперитонеальное дренирование (VARD). Под контролем лапароскопии в ретроперитонеально вводят лапароскопические инструменты, которыми и санируют пораженные ткани. Есть сообщения, что внутригоспитальной летальности к 30 дню при этой методике дает всего 2,5%, что делает ее привлекательной альтернативой. VARD исключает контаминацию брюшной полости, что является его большим преимуществом, однако обычно бывает необходимо несколько процедур, толстую кишку и другое содержимое брюшной полости ни осмотреть, ни лечить при необходимости невозможно.
Некрэктомия
От традиционных резекций при лечении тяжелого острого панкреатита отказались из-за многочисленных осложнений и высокой летальности. При некрэктомии удаляют нежизнеспособные ткани из поджелудочной железы и окружающего ее ретроперитенального пространства, ее можно выполнить открытым способом или по менее инвазивными эндоскопической или лапароскопической методикам. Некрэктомия предназначена для удаления нежизнеспособных тканей без повреждения основных кровеносных сосудов; перед завершением операции необходим тщательный гемостаз. Могут потребоваться повторные дренирующие операции.
Кроме этого, абдоминальные осложнения у пациентов с острым панкреатитом включают сопутствующие проблемы желчевыводящих путей, стресс гастрит и связанные с ним кровотечения, некроз поперечно-ободочной кишки, кровотечения из варикозных вен желудка, вторичных тромбозу селезеночной вены и катастрофические кровотечения из разрывов псевдоаневризм гастродуоденальной артерии или ветвей верхней брыжеечной артерии. В случае массивного желудочно-кишечного кровотечения, после исключения как источника желудочной и проксимальной дуоденальной артерий, следует рассмотреть применение артериографии. Некроз поперечно-ободочной кишки следует заподозрить у пациента с напряжением передней брюшной стенки, вздутием и сепсисом. Состояние пациентов с этой проблемой, как правило, крайне тяжелое. При использовании методики открытого тампонирования типично наблюдаются кишечно-кожные свищи, при использовании других методик они встречаются реже.
Исходы при панкреатите
В одном из исследований, у 35 пациентов, перенесших открытую некрэктомию в процессе лечения острого панкреатита, была выполнена оценка результата при помощи «Краткой Формы 36» (SF-36) для оценки качества жизни, связанного со здоровьем. Из этих 35 к моменту SAP работающими были 32, через 6 месяцев после выписки к работе вернулись 12. Баллы SF-36 превышали 60% у всех пациентов, у 20 из 32 пациентов качество жизни было хорошим (> 70 %). Исходы у пациентов с алкогольным панкреатитом были хуже. У 20 выживших, после длительной (> 30 дней) госпитализации перенесших SAP, 12 из 20 имели морфологические или эндокринные последствия. Проблемы, наблюдавшиеся более, чем через 6 месяцев после выписки включали панкреатические свищи, стеноз панкреатических и/или желчных протоков, а также хроническую боль в животе.
Ключевые моменты
Стоит помнить, что:
- Тяжелый острый панкреатит поражает от 10 до 15% всех пациентов с панкреатитом, и практически вся летальность и осложнения связаны с этой формой заболевания.
- Для начальных стадий тяжелого острого панкреатита характерен синдром системной воспалительной реакции и дисфункция конечных органов, часто требующих интенсивной поддержки сердечно-сосудистой системы. Инфузионная терапия является важным компонентом первичного лечения независимо от причин и тяжести острого панкреатита. Секвестрация жидкости может привести к потери до трети объема плазмы.
- Инфицированный панкреонекроз — наиболее важный фактор риска смерти при этом заболевании. Предупреждение, диагностика и лечение инфекции при тяжелом остром панкреатите критически важны.
- Понимание причины тяжелого острого панкреатита может диктовать выбор тактики лечения. Билиарное происхождение следует заподозрить у женщин старше 40 лет с уровнем аланин аминотрансферазы плазмы, более чем в три раза превышающим верхнюю границу нормы.
- Компьютерная томография (КТ) с контрастированием считается золотым стандартом диагностики панкреонекроза, перипанкреатических скоплений и определения степени тяжелого панкреатита. Индекс Бальтазара имеет диапазон от 0 до 10 и рассчитывается сложением баллов, определяемых по распространенности воспалительного процесса и объему панкреонекроза. Данные, получаемые при этом исследовании, коррелируют с клиническим течением и тяжестью заболевания, однако нет необходимости выполнять его пациентам с легкой формой панкреатита.
- Приблизительно 80% смертей при остром панкреатите связаны с инфекционными осложнениями. Антибиотикопрофилактика часто применяется, но качество данных, поддерживающих эту практику, относительно низкое. Более того, в некоторых современных клинических исследованиях наблюдались проблемы, связанные с антибиотикорезистентностью. Таким образом, рутинно применять антибиотики профилактически не следует.
- Пациентам с тяжелым некротизирующим острым панкреатитом необходима нутритивная поддержка. Энтеральное питание безопасно и эффективно и его лучше вводить в зонд, установленный дистальнее пилорического отдела желудка. У некоторых пациентов катаболизм настолько выражен, что для адекватного питания может потребоваться комбинация энтерального и парентерального питания. Хотя уровни триглицеридов нужно мониторировать, липиды можно использовать в нутритивном обеспечении большинства пациентов.
- Инфицирование поджелудочной железы следует заподозрить у трех групп пациентов: состояние которых не улучшается, состояние которых ухудшается и состояние которых после кратковременного улучшения снова ухудшается. Для исключения инфекции используют КТ с контрастированием или пункционную аспирацию.
- Пациентам с инфицированным панкреонекрозом необходимы санация и/или дренирование поджелудочной железы. Выбор подхода зависит от предпочтений клиники. Методики, превосходство которой над остальными было бы доказано, нет.
- Все чаще при инфицированном панкреонекрозе применяется более консервативный «поэтапный» подход и менее инвазивные средства дренирования у определенных категорий пациентов.
Pamela Lipsett и Mario Rueda (переводчик А.А. Митрохин)