Содержание
- Эпидемиология
- Причины
- Патофизиология
- Диагностика
- Клиника и симптомы
- Лечение — стандартная поддерживающая терапия
- Осложнения
- Клинические исходы и прогноз
Острый респираторный дистресс-синдром (ОРДС) является распространенной проблемой в ОРИТ и осложняет широкий спектр тяжелых заболеваний. Впервые описанный Ashbaugh в 1967 году, синдром был первоначально назван респираторным дистресс-синдромом взрослых, чтобы отличить его от респираторного дистресс-синдрома новорожденных. Однако с учетом того, что ОРДС может возникать у детей, термин «острый» заменили «взрослый» в номенклатуре в знак признания характерного для всех пациентов острого начала, что и определяет синдром. Несмотря на то, что специфические методы лечения ОРДС разрабатываются медленно, новые стратегии механической искусственной вентиляции легких, снижающие летальность, целенаправленное лечение тяжелых форм ОРДС, включающее прон-позицию, миорелаксанты и стратегии управления инфузионной терапией, которые сокращают продолжительность механической вентиляции, подчеркивают важность диагностики и лечения всех пациентов с ОРДС. Несмотря на то, что вопрос кажется простым, на практике ОРДС остается в значительной степени недодиагностированным, и практикующие эксперты могут ошибиться с диагнозом, что приводит к ненадлежащему или неадекватному лечению.
Новые рекомендации от ФАР по ОРДС здесь.
Эпидемиология
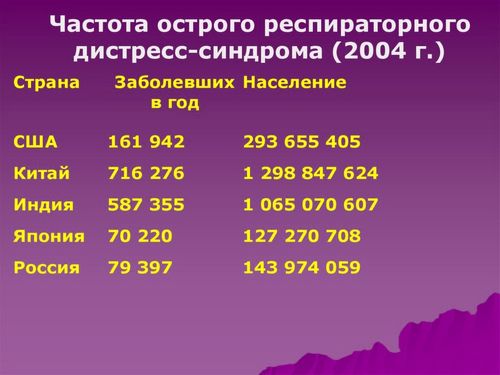
Точную частоту случаев возникновения ОРДС трудно оценить по ряду причин, предполагается частота от 7 до 85 случаев на 100000 человек. В прошлом использовалось различное определение данного синдрома. Широкий спектр причин и сосуществующие процессы заболевания также затрудняли диагностику случаев как на клиническом, так и на административном уровне при кодирования причин заболевания. Национальный Институт Здоровья США (NIH) впервые оценил частоту на уровне 75 на 100000 населения в 1977 году, в то время как в ряде исследований с той поры были зафиксированы более низкие показатели. Два проспективных исследования подтвердили высокий уровень частоты ОРДС, представленный ранее Национальным Институтом Здоровья. Первоначально внедренные Национальным Институтом сердца, легких и крови регистрационные логи, заполнение которых спонсировала сеть ARDS Network в 20 больницах, позволили подсчитать, что частота может достигать 64 случаев на 100000 населения. Преимущество этой оценки данных заключается в том, что это было перспективное исследование в большом числе академических медицинских центров. Вторым было большое перспективное исследование жителей округа Кинг, штат Вашингтон. В этом исследовании частота встречаемости ОРДС у взрослых составляла 78,9 на 100000 пациентов в год. В большом проспективном Европейском исследовании было установлено, что на ОРДС приходится 7,1 % всех госпитализаций. В нескольких исследованиях показано снижение заболеваемости ОРДС с течением времени. Например, большая проспективная когорта пациентов с травмой, имеющих риск возникновения ОРДС и полиорганной недостаточности, данные собраны в период с 1997 по 2004 годы, показала, что частота ОРДС снизилась с 43% в 1997 году до 12 % в 2004 году, что может отражать успехи интенсивной помощи при тяжелой травме. В популяционном исследовании в графстве Олмстед, штат Миннесота, число случаев ОРДС снизилось с 82,4 до 38,9 на 100000 человек в год с 2001 по 2008 годы, несмотря на одновременное увеличение тяжести синдрома, числа сопутствующих заболеваний и более высокую распространенность основных предрасполагающих факторов возникновения ОРДС. В 1-годичном обсервационном исследовании в Испании было сообщено о возникновении ОРДС с частотой 7,2 на 100000 населения в 2008 и 2009 годах в эру рутинного применения вентиляции с малым дыхательным объемом. Независимо от истинной частоты, ОРДС представляет собой серьезную проблему для системы общественного здравоохранения, часто встречающуюся в практике всех врачей, которые занимаются лечением критических пациентов.
Причины

ОРДС почти всегда возникает по причине наличия предрасполагающих клинических факторов риска, причем риск возрастает при наличии нескольких факторов. Наиболее распространенные клинические факторы риска могут быть разделены на те, которые:
- непосредственно повреждают легкие («прямой ОРДС»),
- повреждают легкие косвенно («непрямой ОРДС»).
Прямые причины
Хотя не всегда возможно определить точную причину возникновения ОРДС у данного пациента, прямые причины, по-видимому, составляют примерно половину всех случаев ОРДС. Независимо от основной причины, большинство пациентов с ОРДС имеют системную воспалительную реакцию и дисфункцию органов, которая не ограничивается легкими.
Непрямые (косвенные) причины
Сепсис является наиболее распространенной причиной непрямого повреждения легких, при этом общий риск возникновения ОРДС составляет примерно 30-40% среди пациентов с тяжелым сепсисом, которым требуется госпитализация в ОРИТ. Помимо самого сепсиса, который является фактором риска развития ОРДС, источник инфекции может также влиять на риск повреждения легких. У пациентов, поступивших в ОРИТ по поводу сепсиса, у пациентов, у которых пневмония является источником сепсиса, риск развития ОРДС более высок по сравнению с инфекциями другой локализации (брюшная полость, кожа, мягкие ткани и т. д.). Тяжелая травма, сопровождающаяся шоком, и множественные переливания крови также могут вызывать непрямое поражение легких. Хотя другие причины косвенного повреждения легких встречаются реже, многие, например переливание крови, являются обычными событиями в условиях ОРИТ. Наиболее распространенной причиной прямого повреждения легких является пневмония, которая может быть бактериального, вирусного (в частности при коронавирусе) или грибкового происхождения.
Вторичные факторы также могут увеличить риск развития ОРДС. К таким факторам относятся:
- хронические заболевания легких,
- хроническое или острое злоупотребление алкоголем,
- курение сигарет,
- большой возраст,
- переливание компонентов крови,
- резекция легких и ожирение.
Напротив, несколько исследований показали, что у пациентов с сахарным диабетом реже развивается ОРДС. В определенной степени каждый пациент в ОРИТ подвержен риску развития ОРДС, и необходима бдительность для того, чтобы распознать диагноз и должным образом назначить терапию.
Патофизиология
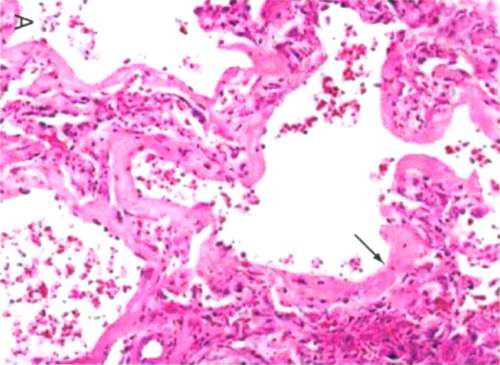
Заполнение альвеол жидкостью возникает в результате повреждения альвеолярно-капиллярного барьера и является основной причиной гипоксемии и изменением механики легких, которые характеризуют ранние стадии ОРДС.
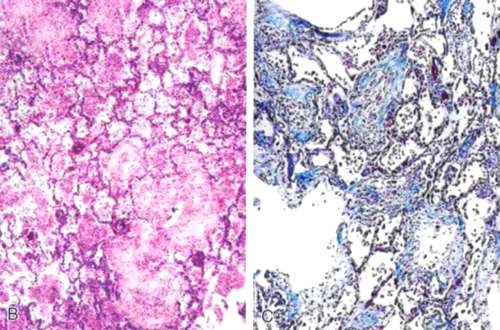
Альвеолярно-капиллярный барьер формируется из двух отдельных клеточных слоев:
- эндотелия микрососудов,
- альвеолярного эпителия.
Повреждение альвеолярного эпителия является важной гистологической особенностью, с потерей целостности альвеолярного эпителиального барьера и вслушиванием» альвеолярных эпителиальных клеток (альвеолоцитов) I типа. Апоптоз альвеолярного эпителия широко распространен и, вероятно, вносит вклад в потерю эпителия, наблюдаемого при исследовании ультраструктуры. Хотя повреждение эндотелия менее очевидно на микроскопическом уровне, ультраструктурные исследования показывают, что оно широко распространено и сопровождается повышенной проницаемостью эндотелия. Повреждение эндотелия сопровождается утечкой плазмы из капилляров в интерстиций и альвеолы. Наводнение альвеол при ОРДС происходит богатой белком отечной жидкостью из-за повышенной проницаемости альвеолярного капиллярного барьера, в отличие от низкобелкового отека легких, который возникает в результате гидростатических причин, таких как застойная сердечная недостаточность или острый инфаркт миокарда. Со временем патологические изменения при ОРДС развиваются так, что острое воспаление и отек легких становятся менее выраженными и может появиться фиброзирующий альвеолит. Недавние исследование аутопсийного материала показало, что фибропролиферативные изменения могут наблюдаться уже на ранних стадиях ОРДС и могут сосуществовать с экссудативными изменениями.
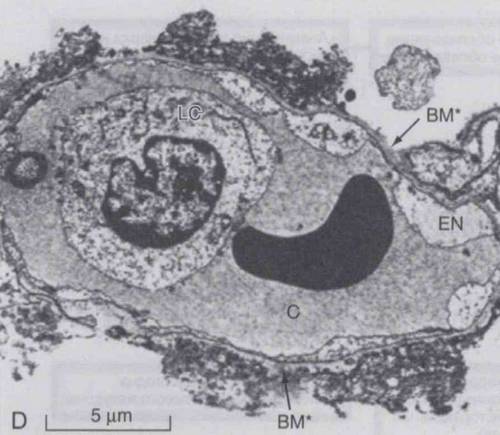
Нейтрофилы играют важную роль в начальной воспалительной реакции при ОРДС. Ранний ОРДС характеризуется миграцией нейтрофилов в альвеолы. Нейтрофилы могут высвобождать целый ряд повреждающих молекул, включая протеазы, такие как:
- нейтрофильная эластаза,
- коллагеназа,
- желатиназа А и В,
- свободные радикалы азота и кислорода.
Кроме того, они могут вырабатывать провоспалительные цитокины и хемокины, которые усиливают воспалительную реакцию в легких. Недавние данные свидетельствуют о том, что нейтрофильные внеклеточные ловушки (НВЛ), которые содержат ДНК, гистоны и другие внутриклеточные белки, могут действовать как молекулярные паттерны, ассоциированные с повреждением (DAMP) в усилении иммунного ответа при ОРДС. Резидентные альвеолярные макрофаги также участвуют в инициировании и поддержании провоспалительного цитокинового каскада, который приводит к «миграции» нейтрофилов в легкие.
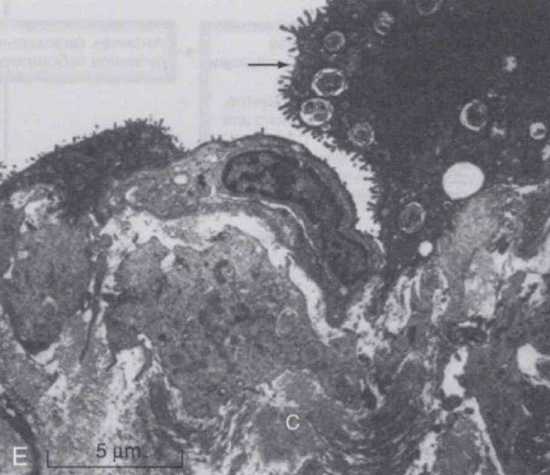
Помимо острого нейтрофильного воспаления и выработки провоспалительного цитокинового каскада, целый ряд других компонентов способствуют патогенезу ОРДС. Дисфункция сурфактанта характерна с нарушениями как в белковом, так и липидном компонентах и, вероятно, является следствием нарушения нормальной активности сурфактанта за счет притока белков плазмы в альвеолы, внутриальвеолярного протеолиза и повреждения альвеолярных эпителиальных клеток (альвеолоцитов) II типа. Дисфункция сурфактанта может иметь важные последствия как для легочной механики, так и для защиты организма. Активация коагуляционного каскада и нарушение фибринолиза также имеет место у пациентов с ОРДС, как в самих легких, так и в организме в целом. Наблюдается изменение баланса эндогенных оксидантов и антиоксидантов со снижением уровня эндогенных антиоксидантов, несмотря на повышенную выработку оксидантов.
Все более широкое признание получило вентилятор-ассоциированное повреждение легких как компонент патогенеза ОРДС. Существует несколько механизмов, посредством которых механическая вентиляция может повредить легкие. Вентиляция с большими дыхательными объемами и давлениями может повредить даже нормальные легкие, что приводит к повышенному проницаемости и отеку легких вследствие капиллярного стресса и устойчивого повышения циркулирующих цитокинов в плазме. В поврежденном легком даже дыхательные объемы, которые хорошо переносятся нормальным легким, могут привести к альвеолярному пере-растяжению в относительно неповрежденных участках, поскольку легкое, доступное для распределения дыхательного объема, значительно уменьшается и распределение дыхательного объема является неравномерным. Помимо альвеолярного перерастяжения, циклическое открытие и закрытие ателектатических альвеол, находящихся в состоянии ателектаза, может вызвать повреждение легких даже при отсутствии альвеолярного перерастяжения. Комбинация альвеолярного перерастяжения с циклическим открытием и закрытием альвеол особенно опасна и может инициировать провоспалительный цитокиновый каскад. Вентиляторная стратегия, которая была разработана для минимизации альвеолярного перерасгяжения и максимального увеличения рекрутированных альвеол, снизила этот провоспалительный цитокиновый выброс. Фундаментальное понимание патогенеза ОРДС в клинике привел к многочисленным клиническим исследованиям новых стратегий вентиляции для пациентов с ОРДС, включая ключевое исследование ARDS Network по использованию дыхательного объема, равного 6 мл/кг против 12 мл/кг и несколько исследований с высоким уровнем положительного давления в конце выдоха (PEEP) с рекрутмент-маневрами или без них для максимального увеличения числа рекрутированных альвеол.
Хотя основное лечение всех пациентов с ОРДС сходно независимо от причины, новые данные указывают на то, что внутри ОРДС могут быть биологически и клинически различные фенотипы, которые могут по-разному реагировать на лечение. Одним из таких различий является течение заболевания у пациентов, у которых развивают ОРДС в результате прямого повреждения легких (вторичного по отношению к пневмонии или аспирации), и тех, у кого имеется первично непрямое повреждение легких из-за системного поражения (вторичного по отношению к сепсису или панкреатиту). Является ли различие между прямым и непрямым повреждением легких клинически полезным, неясно. Некоторые исследователи продемонстрировали большее снижение комплайнса легких у пациентов с ОРДС, вызванных прямым повреждением легких, по сравнению с непрямыми причинами, хотя общий комплайнс дыхательной системы (включая грудную клетку) был схожим в обоих случаях. Улучшение механических свойств легких может быть более вероятным у пациентов с прямым повреждением легких при применении маневров ПДКВ и рекрутмента альвеол. Исследования биомаркеров показывают, что у пациентов с прямым повреждением легких есть больше доказательств повреждения эпителия легких, в то время как у лиц с непрямым повреждением легких больше доказательств повреждения эндотелия. Однако в самой большой группе пациентов, изученных до настоящего времени, не было разницы в летальности между пациентами с прямыми (легочными) и непрямыми (внелегочными) причинами повреждения легких.
Потенциально более клинически полезное различие получено между подтипами ОРДС с использованием статистических подходов. Calfee с коллегами использовал латентный анализ классов для выявления двух отдельных подтипов ОРДС среди пациентов, включенных в два крупных клинических исследования, основанных на клинических, лабораторных и биомаркерных данных. Одна группа характеризовалась высоким уровнем провоспалительных цитокинов, более высокой частотой использования вазопрессоров, большей распространенностью сепсиса и снижением уровня бикарбоната в плазме крови (гипервоспалительный подтип). У этой группы была более высокая летальность и меньшее число дней, свободных от механической вентиляции легких дней без вентилятора и большая частота возникновения полиорганной недостаточности по сравнению с группой, которая имела подтип низким уровнем воспаления. Самое интересное, что такие же две группы с аналогичными определяющими признаками были независимо получены из двух больших, гетерогенных когорт пациентов. Выявление биологически и клинически значимых эндотипов потенциально может изменить терапевтические подходы к ОРДС и, вероятно, станет акцентом многих будущих исследований.
Диагностика
Клинические критерии
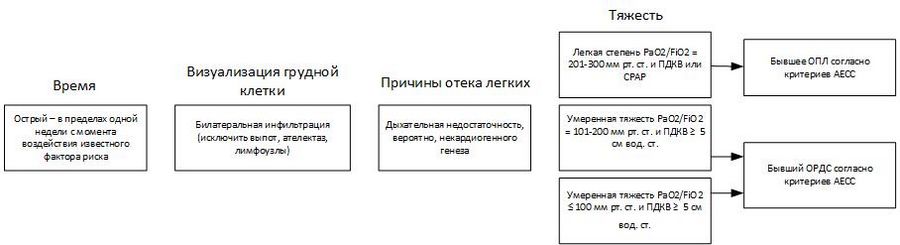
Несколько клинических определений были использованы для диагностики ОРДС, с момента первого описания синдрома в 1967 году. До 1994 года использовалось множество определений, включая шкалу повреждения легких Мюррея. В 1994 году Американо-Европейская согласительная конференция (АЕСС) опубликовала новые клинические определения для острого повреждения легких (ОПЛ) и ОРДС. Эти определения были недавно изменены, а их модифицированная версия, именуемая Берлинскими дефинициями, в настоящее время является основным диагностическим инструментом ОРДС, как для клинической диагностики, так и для исследований. Эти дефиниции отличаются от определения АЕСС несколькими важными положениями:
- Во-первых, в новом определении нет термина «острое повреждение легких» (ОПЛ), используется только термин «ОРДС», который в настоящее время характеризуется легкой, средней или тяжелой степенью гипоксии.
- Во-вторых, есть указание на то, что начало ОРДС, включая двусторонние инфильтраты на рентгенограмме грудной клетки, имеет место в течение 1 недели с момента реализации повреждающих факторов.
Чтобы соответствовать определению, пациенты должны дышать с постоянным положительным давлением в дыхательных путях > 5 см вод. ст.; для легкого ОРДС это давление в дыхательных путях может быть достигнуто постоянной вентиляцией с положительным давлением. Тяжесть классифицируется по степени гипоксемии как:
- легкой,
- средней,
- тяжелой степени.
У всех пациентов с подозрением на ОРДС следует искать причину острого повреждения легких. В отсутствие явно идентифицируемой основной причины особое внимание следует уделять возможности других причин легочных инфильтратов и гипоксемии, таких как гидростатический (кардиогенный) отек легких. Наконец, в Берлинских дефинициях признается, что повышенное давление с сосудах и ОРДС могут сосуществовать; в Берлинских дефинициях нет абсолютного требования исключить кардиогенную причину отека легких, если дыхательная недостаточность пациента не может быть полностью объяснена фактором риска ОРДС. В этих случаях можно использовать объективную оценку функции сердца, такие как эхокардиография или катетеризация легочной артерии.
Одним из потенциальных ограничений применения Берлинских дефиниций является необходимость отбора проб артериальной крови для расчета отношения РaO2/ FiO2.
Недавнее исследование показало хорошую корреляцию между отношением SpO2/FiO2 (измеренным методом пульсовой оксиметрии) и отношением PaO2/FiO2, с отношением SpO2/FiO2, равным 235, что соответствует отношению PaO2/FiO2 = 200 и отношение SpO2/FiO2, равное 315, соответствующее соотношению PaO2/FiO2 = 300. Эти корреляции справедливы только тогда, когда SpO2 составляет менее 98%, поскольку кривая диссоциации оксигемоглобина является плоской выше этого уровня. Поскольку измерение насыщения гемоглобина кислородом является неинвазивным, непрерывные измерения и использование отношения SpO2/FiO2 в дополнение к соотношению PaO2/FiO2 могут улучшить способность клиницистов диагностировать ОРДС. Однако SpO2 еще не включен в официальные определения ОРДС.
Дифференциальная диагностика между ОРДС и гидростатическим отеком может быть затруднена, и может иметь значительное совпадение этих синдромов.
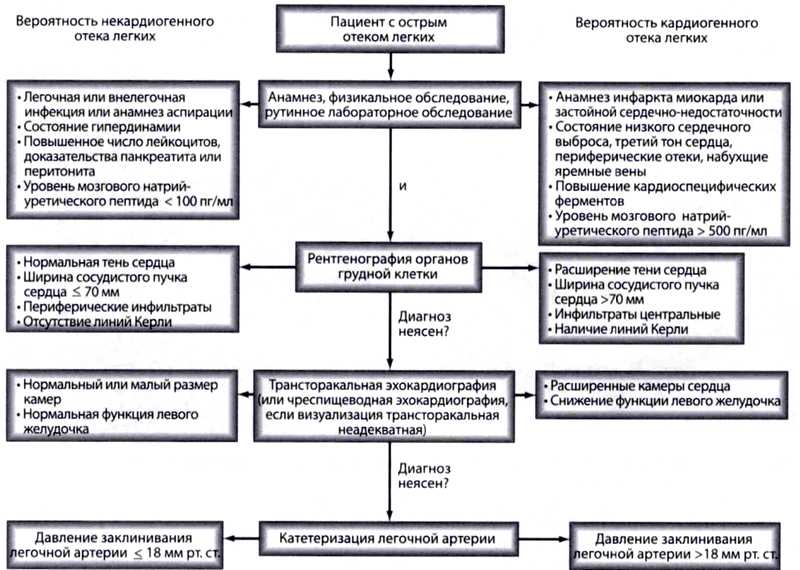
Многоцентровое исследование стратегий внутривенной инфузионной терапии, основанной на катетеризации легочной артерии у пациентов с ОРДС, показало, что 29% пациентов с клинически установленным ОРДС имели ДЗЛА > 18 мм рт. ст., определенного с помощью катетера в легочной артерии, но у 97 % был нормальный или повышенный сердечный индекс, что свидетельствует о том, что у них не было клинической сердечной недостаточности. Другие исследования показали аналогичные показатели повышенного ДЗЛА у пациентов с ОРДС. Нет никаких конкретных клинических или лабораторных исследований, которые могли бы достоверно различать ОРДС и гидростатический отек легких.
Изучение диагностической полезности сывороточных уровней натрийуретического пептида В-типа (BNP) показало, что BNP, измеренный при поступлении, не может помочь достоверно различить гидростатический отек легких и ОРДС. Кроме того, уровни BNP у этих пациентов не коррелировали с инвазивными гемодинамическими измерениями. Nt-BNP также был повышен при ОРДС, что не обязательно коррелируют с ДЗЛА.
Хотя стандартизация определений ОРДС имела огромное значение для клинической практики и клинических исследований, природа ОРДС такова, что любое определение будет иметь недостатки. Во-первых, Берлинские дефиниции основаны исключительно на клинических критериях, потому что в настоящее время нет лабораторного теста, который позволяет осуществить клиническую оценку наличия или отсутствия ОРДС. Во-вторых, в них не указано наличие или отсутствие полиорганной недостаточности как важной детерминанты результата. Наконец, хотя наличие двусторонних инфильтратов и имеет большое прогностическое значение и, несомненно, является отличительной чертой синдрома, рентгенографические данные не являются специфичными для ОРДС, и ряд других состояний могут имитировать ОРДС.

По этим причинам диагностическая неопределенность ОРДС распространена, является основным барьером для начала соответствующей терапии, и является одной из основных причин, почему клиницисты не могут начать протективную вентиляцию легких у пациентов с соответствующей клиникой.
Инвазивные методы
У большинства пациентов первоначальная диагностика ОРДС проводится клинически. Инвазивные процедуры для диагностики ОРДС имеют ограниченную клиническую ценность, их преимущества часто не превышают риски. Среди доступных методов потенциально инвазивной диагностики наиболее часто используется бронхоскопия. Бронхоскопия показана на ранних стадиях ОРДС у пациентов, у которых нет определенного фактора риска возникновения ОРДС и иммунодефицита. Бронхоальвеолярный лаваж с культуральными исследованиям и цитологическое исследование могут идентифицировать причину пневмонии и особенно полезны для диагностики оппортунистических инфекций. Лаважная жидкость обычно имеет преобладание нейтрофилов, и могут быть признаки диффузного альвеолярного кровоизлияния. Цитологическое исследование может быть использовано для подтверждения наличия диффузного повреждения альвеол. Редко выявляется альтернативный диагноз, такой как острая эозинофильная пневмония, легочный альвеолярный протеиноз, диффузное альвеолярное кровоизлияние или непредполагаемая инфекция.
Раньше для диагностики чаще проводилась открытая биопсия легкого. Интересно, что степень гистологических изменений при биопсии легкого не коррелирует в конечном итоге с изменением функции легких. Открытая или торакоскопическая биопсия легкого может быть полезной в некоторых случаях, когда диагноз неясен и основная причина не очевидна. Хотя открытая биопсия легкого может обеспечить результаты, которые приводят к изменению лечения, мета-анализ опубликованных серий случаев показал, что послеоперационные осложнения имели место у 22 % пациентов. Несколько патологоанатомических исследований показали, что биопсия или аутопсия могут идентифицировать неподтвержденные диагнозы, требующие специфической терапии, такие как милиарный туберкулез, бластомикоз легких, аспергиллез или облитерирующий бронхиолит сопровождающийся пневмонией в 40-60% случаев; однако общая применимость этих исследований может быть ограничена тем фактом, что они были ретроспективными сериями случаев. В мета-анализе опубликованных исследований открытая биопсия легкого изменила лечение в 73% случаев; результаты биопсии, которые изменяют лечение, могут быть связаны с лучшим выживанием.
В дополнение к знакомству с Берлинскими дефинициями ОРДС, клиницист должен знать, что ОРДС также был назван множеством других терминов, некоторые из которых встречаются в основном в более старой литературе, но некоторые из них остаются в клиническом использовании. Некоторые наиболее распространенные из этих терминов называются: болезнь гиалиновых мембран взрослых, постперфузионное легкое или «насосное» легкое (имеется в виду насос аппарата искусственного кровообращения), шоковое легкое, вентилятор-ассоциированное повреждение легких и синдром дыхательной недостаточности взрослых. Термины реперфузионный отек легких, первичная дисфункция трансплантата, первичное повреждение трансплантата и синдром трансплантированного легкого были использованы для описания ОРДС, возникающего сразу после трансплантации легкого. Независимо от применяемого названия, ОРДС является клиническим синдромом, который имеет большее прогностическое и терапевтическое значение в сравнении с основной его причиной (то есть инфекций, вирусами (например, коронавирус), аспирацией, травмой и т. д.). Этот факт не уменьшает необходимость идентифицировать эти первопричины, если они присутствуют, и относиться к их лечению агрессивно.
Клиника и симптомы
Ранний ОРДС
Берлинские дефиниции направлены на то, чтобы идентифицировать пациентов с ОРДС в ранний период, в острой или экссудативной фазе. Клинически острая фаза проявляется острым началом рентгенографических инфильтратов в соответствии с отеком легких, гипоксемией и повышенной работой дыхания. Инфильтраты на рентгенограмме являются двусторонними (по определению), но могут быть пятнистыми или диффузными, пушистыми или плотными, и может быть плевральный выпоты.
Компьютерная томография грудной клетки (КТ), хотя и редко используется клинически, широко применяется как исследовательский инструмент для лучшего определения характера рентгенографических инфильтратов у пациентов с ОРДС. Распределение инфильтратов по КТ удивительно изменчиво. Хотя у некоторых пациентов имеются свидетельства диффузного альвеолярного отека на КТ, у многих пациентов имеются много очаговых инфильтратов с областями наполнения альвеол жидкостью и консолидации, происходящие преимущественно в пораженных зонах, в то время как непораженные области относительно свободны. Однако даже обычные рентгенограммы могут иметь существенное значение при решении вопроса взятия проб с использованием бронхо-альвеолярного лаважа или визуализации с использованием ПЭТ с фтордезоксиглюкозой. Пациенты с множественными диффузными инфильтратами могут с большей вероятностью реагировать на рекрутмент-маневры; но может ли КТ-визуализация быть полезной для настроек параметров вентиляции, пока не известно.
Гипоксемия, которая характеризует ранний ОРДС, обычно относительно рефрактерна к дополнительной оксигенотерапии. Повышенная работа дыхания в острой фазе ОРДС обусловлена снижением комплайнса (растяжения) легких, в результате альвеолярного и интерстициального отека, в сочетании с повышенным сопротивлением дыхательных путей воздушному потоку и усилением респираторного драйва. Комбинация гипоксемии и повышенной работы дыхания обычно требует эндотрахеальной интубации и механической вентиляции, хотя иногда пациентам может быть достаточно неинвазивной вентиляцией или высокопоточной ингаляции кислорода через носовые канюли.
В дополнение к гипоксемии и повышенной работе дыхания, у многих пациентов с ОРДС также развиваются признаки повышенного сопротивления легочных сосудов, приводящие к легочной гипертензии и острой недостаточности правого желудочка (ПЖ). Распространенность легочной гипертензии у пациентов, госпитализированных с ОРДС, может достигать 92 %. Даже в эпоху вентиляции низкими дыхательными объемами, чреспищеводная эхокардиография показала признаки острого правожелудочкового поражения у 22% из 226 последовательных пациентов с умеренным (средней тяжести) или тяжелым ОРДС, что было связано с почти двукратным увеличением 28-дневной летальности. Попытки уменьшить легочную гипертензию и поражение ПЖ с помощью легочных вазодилататоров, таких как силденафил, привели к снижению давления в легочной артерии, но также и к сопутствующему увеличению фракции шунта и уменьшению оксигенации. Эти результаты свидетельствуют о том, что хотя у пациентов с ОРДС имеются признаки легочной гипертензии, в некоторых случаях это может быть компенсаторным физиологическим ответом для снижения притока крови к участкам поврежденного легкого.
Поздний фибропролиферативный ОРДС
У большинства пациентов ОРДС существенно регрессирует после острой фазы. Однако в ряде случаев синдром прогрессирует до фиброзирующего альвеолита. Фиброзирующий альвеолит обычно становится клинически очевидным через 7-10 дней, хотя доказательства отложения внеклеточного матрикса были идентифицированы в альвеолярной жидкости у пациентов уже в первый день после интубации, а аутопсийные исследования показывают наличие ранних фиброзные изменения у некоторых пациентов. Рентгенографически линейные затемнения возникают в соответствии с развивающимся фиброзом. Гистологически отек легких и нейтрофильная инфильтрация менее выражены. Тяжелый фибропролиферативный процесс заполняет воздухоносную паренхиму грануляционной тканью, которая содержит внеклеточный матрикс, богатый коллагеном и фибрином, а также новые кровеносные сосуды и пролиферирующие мезенхимальные клетки.
Клинически поздняя фибропролиферативная фаза ОРДС характеризуется постоянной потребностью в механической вентиляции, часто с постоянно высокими уровнями PEEP и FiO2. Легочный комплайнс может снизиться еще больше, а мертвое дыхательное пространство увеличивается. Если легочная гипертензия не возникла в острой фазе ОРДС, то теперь она развивается из-за облитерации легочного капиллярного русла, и возможного нарушения функции правого желудочка. Этот этап болезни может быть длиться недели и может быть очень плохим для клиницистов, пациента и его семьи, поскольку улучшения функции легких часто компенсируются новыми проблемами, такими как внутрибольничные инфекции и внелегочная органная дисфункция. Поэтапная отмена может привести к трудностям окончательного отлучения от механической вентиляции, если этап фиброзирующего альвеолита продлевается. Основываясь на увеличение количества дней, свободных от вентилятора, за счет использования низких дыхательных объемов, представляется вероятным, что частота фиброзирующего альвеолита снижается. Тем не менее недавнее аутопсийное исследования выявило большие фиброзные изменения у пациентов, лечившихся в эпоху с низким дыхательным объемом, чем у пациентов с высокими дыхательными объемами. Одно из возможных объяснений заключается в том, что улучшение поддерживающей терапии увеличивает продолжительность жизни некоторых пациентов с более тяжелым поражением легких, что создает время для развития фиброзных изменений и обнаружения их при аутопсии.
Разрешение ОРДС
Биопсии легких у выживших после ОРДС обычно показывают нормальную или почти нормальную гистологию легкого. Для того чтобы такое гистологически полное разрешение ОРДС могло произойти, необходимо обратить вспять различные процессы. Альвеолярный отек активно реабсорбируется путем направленного транспорта натрия и хлорида из дистальных отделов дыхательных путей и альвеолярных пространств в интерстиций легких, где он может быть удален через лимфатическую систему или путем реабсорбции в сосудистую систему. Вода пассивно абсорбируется за счет осмотического градиента, возможно через водные каналы, аквапорины. У большинства пациентов с ранним ОРДС имелось нарушение транспорта альвеолярной жидкости; у пациентов с интактным транспортом альвеолярной жидкости более высокие скорости альвеолярного эпителиального транспорта жидкости связаны с лучшими результатами. Растворимый и нерастворимый белок также должны быть подвергнуты клиренсу альвеол. Растворимый белок, вероятно, диффундирует по околоклеточному пути в интерстиций, где он удаляется через лимфатическую систему. Нерастворимый белок, вероятно, удаляется за счет фагоцитоза макрофагов или эндоцитозом и трансцитозом альвеолярных эпителиальных клеток.
Поврежденный альвеолярный эпителий необходимо восстановить. Альвеолярная эпителиальная клетка типа II служит в качестве клетки-предшественника для восстановления альвеолярного эпителия. Клетки II типа пролиферируют, мигрируют и дифференцируются для воссоздания плотного альвеолярного эпителиального клеточного барьера I типа. Также должен быть устранен воспалительная клеточная инфильтрация, но здесь механизмы менее ясны. Разрешение скопления нейтрофилов может быть осуществлено преимущественно посредством апоптоза нейтрофилов и фагоцитоза их макрофагами. Тем не менее в одной из статей указывается, что в легких пациентов с ОРДС нарушается апоптоз нейтрофилов. Разрешение фиброзных изменений также недостаточно изучено. Очевидно, что для восстановления нормальной или почти нормальной альвеолярной архитектуры необходимо существенное ремоделирование. У пациентов с выраженным фиброзом этот процесс, вероятно, наблюдается в течение многих месяцев, так как аномалии функции легких продолжают уменьшаться, иногда довольно эффективно в течение первого года и далее у выживших пациентов с ОРДС.
Лечение — стандартная поддерживающая терапия
Коррекция предрасполагающих факторов
Прежде всего, следует предпринять поиск основной причины ОРДС. Надлежащее лечение любой инфекции, вызывающей ОРДС, такой как пневмония или сепсис, имеет решающее значение для повышения шансов на выживание. У пациента с иммунодефицитом может потребоваться инвазивная диагностическая оценка, включая бронхоскопию, для поиска доказательств оппортунистических инфекций. У пациента с сепсисом и ОРДС неизвестного источника следует учитывать наличие внутрибрюшного процесса. Своевременное хирургическое лечение абдоминального сепсиса связано с лучшими исходами. У некоторых пациентов причина поражения легких не поддаётся идентификации (например аспирация содержимого желудка) или станет трудной для идентификации.
Управление жидкостным балансом и гемодинамикой
На протяжении десятилетий существовало разногласие относительно лучшей стратегии инфузионной терапии у пациентов с ОРДС. Сторонники либеральной инфузионной жидкостной стратегии пришли к выводу, что увеличение циркулирующего объема крови позволяет сохранить перфузию органов и защитить пациентов от развития внелегочных органных повреждений. Снижение внутрисосудистого объема крови может оказывать неблагоприятное воздействие на сердечный выброс и перфузию тканей, что может способствовать полиорганной недостаточности. Эта озабоченность является обоснованной, поскольку летальность при ОРДС обычно связана с внелегочными причинами, в том числе нарушениями функции других органов. Другие поддерживают консервативную жидкостную стратегию в попытке уменьшить циркулирующий объем крови, тем самым уменьшая движущую силу возникновения отека легких. В экспериментальном повреждении легких низкое давление в левом предсердии связано с меньшей частотой отека легких. Некоторые ограниченные клинические исследования подтверждают этот подход. Из-за этого ARDS Network провела большое, многоцентровое, рандомизированное контролируемое исследование по управление инфузионной терапией на основе катетеризаций (центральный венозный катетер против катетера легочной артерии) у пациентов с ОРДС. После того, как было установлено, что пациенты находятся в шоке, они были рандомизированы в группу с либеральной стратегией инфузионной терапии, которая привела к аккумуляции по 1 л жидкости в день или в группу с консервативной стратегией инфузионной терапии с агрессивным использованием диуретиков для достижения ЦВД < 4 или ДЗЛА < 8, что приводило к среднему нулевому накоплению жидкости к 7-му дню. Хотя не было различий в летальности через 60 дней (первичный исход исследования), пациенты в «консервативной» группе имели лучшую оксигенацию и значительно большее число дней свободных от вентилятора без развития дополнительных органных повреждений. В этом исследовании не имело значения, проводилось ли лечение под контролем измерений центрального венозного давления (полученных из центральной венозной линии) или под контролем измерений давления заклинивания легочной артерии (полученных из катетера легочной артерии).
Несмотря на выводы в поддержку консервативной стратегии инфузионной терапии у пациентов с ОРДС, по-прежнему сохраняется большая неопределенность в отношении соответствующих целей гемодинамической поддержки при ОРДС. В настоящее время рекомендуемая стратегия направлена на достижение наименьшего внутрисосудистого объема, который поддерживает адекватную перфузию тканей, измеряемую по мочеотделению, перфузии других органов и кислотно-основному состоянию с использованием контроля центрального венозного давления. Если перфузия органа не может поддерживаться в условиях адекватного внутрисосудистого объема, то для восстановления перфузии органов следует использовать введение вазопрессоров и/или инотропных препаратов. Имеющиеся данные не подтверждают эффективность использования одного конкретного вазопрессора или комбинации вазопрессоров. После того, как шок разрешится, у пациентов следует использовать консервативной инфузионную стратегию с целью поддержания ЦВД < 4, чтобы поддерживать баланс жидкости у каждого пациента в нулевой точке в период их нахождения в отделении реанимации и интенсивной терапии.
Питание
Стандартный поддерживающий уход за пациентом с ОРДС включает обеспечение адекватного питания. Энтеральный путь предпочтителен парентеральному пути и связан с меньшими инфекционными осложнениями.
Энтеральное питание также может иметь другие благоприятные эффекты. В эксперименте отсутствие энтерального питания способствовало транслокации бактерий из кишки. У здоровых добровольцев введение парентерального питания увеличивало уровни TNF-α, глюкагона и адреналина и повышало частоту лихорадки по сравнению с добровольцами, получавшими энтеральное питание.
Цели нутритивной поддержки у любого пациента в критическом состоянии включают обеспечение адекватными питательными веществами, порывающими уровень метаболизма пациента, а также коррекцию и профилактику любого дефицита микро- или макроэлементов. Является ли конкретная диетическая композиция полезной для пациентов с ОРДС, не понятно. Иммуномодуляция посредством выбора диеты была предпринята рядом исследователей у пациентов в критическом состоянии, с помощью различных комбинации омега-3 жирных кислот, рибонуклеотидов, аргинина и глутамина. Мета-анализ этих исследований показал благоприятное влияние на частоту возникновения инфекции, но не общую летальность. Однако большое, многоцентровое рандомизированное плацебо-контролируемое исследование омега-3 жирных кислот и антиоксидантных добавок у пациентов с ОРДС было прекращено при мониторинге безопасности данных в связи с тенденцией к увеличению летальности у пациентов, получавших дополнительно омега-3 жирные кислоты. Используя другой подход, диета с высоким содержанием жиров и низким содержанием углеводов уменьшала продолжительность механической вентиляции легких у пациентов с острой дыхательной недостаточностью. Хотя механизм этого положительного эффекта был постулирован, как обусловленный снижением дыхательного коэффициента и, как следствие, снижением выработки углекислого газа; наиболее частой причиной высокого респираторного коэффициента у пациентов в критическом состоянии является не состав диеты, а просто гипералиментация. Изучение клинических исходов у 1000 пациентов с ОРДС, рандомизированных в группу с полноценной калорической плотностью или в группу с трофическим типом питания, не выявило различий в летальности или других клинических исходов. В целом, до сих пор нет убедительных доказательств в поддержку использования чего-либо иного, кроме стандартной (энтеральной) нутритивной поддержки, с предотвращением гипералиментации у пациентов с ОРДС. Вопрос о том, как рано начинать кормление, остается без ответа.
Механическая искусственная вентиляция
Протективная вентиляция легких
Хотя исторически первым пациентам с ОРДС был рекомендован дыхательный объем, равный 12-15 мл/кг, теперь становится ясно, что низкий дыхательный объем, и стратегия ограничения давления плато на вдохе снижает летальность. В 2000 году NIH ARDS Network опубликовала результаты своего первого рандомизированного контролируемого многоцентрового клинического исследования у 861 пациента. Это исследование проводилось для сравнения стратегии вентиляции с низким дыхательным объемом (6 мл/кг предсказанной массы тела, давление плато < 30 см вод. ст.) с группой с высоким дыхательным объемом (12 мл/кг предсказанной массы тела, давление плато < 50 см вод. ст.). Обоснованием для данного клинического исследования явился растущий объем клинических и экспериментальных данных, свидетельствующих о том, что вентиляция с высоким дыхательным объемом и высоким давлением плато может быть вредной для поврежденных легких. В этом исследовании госпитальная летальность составила 40% в группе с дыхательным объемом 12 мл/кг и 31 % в группе 6 мл/кг, сниженная на 22%. В группе с низким дыхательным объемом было также значительно больше число дней, свободных от вентилятора и число дней без полиорганной недостаточности. Эти результаты были поистине замечательными, поскольку ни одно крупное рандомизированное клиническое исследование какой-либо специфической терапии ОРДС никогда не демонстрировало снижение летальности.
Сегодняшние рекомендации по стратегии лечения пациентов с ОРДС суммированы в таблице ниже.

Предсказанная масса тела рассчитывается на основе истинного роста с использованием уравнений. Это ключевой момент, который часто игнорируют клиницисты; использование фактической, а не предсказанной массы тела может привести к использованию ошибочно высоких и потенциально вредных дыхательных объемов, особенно при ожирении. Первоначально дыхательный объем должен быть установлен на уровне 6 мл/кг предсказанной массы тела. Интересно, что дыхательный объем 6 мл/кг предсказанной массы тела примерно равен нормальному дыхательному объему у самостоятельно дышащих взрослых людей в состоянии покоя. Таким образом, хотя этот конкретный дыхательный объем часто называют низким дыхательным объемом, это в действительности нормальный дыхательный объем.
Однако если давление плато в конце вдоха (измеренное во время 0,5-секундной паузы) все еще > 30 см вод. ст., то дыхательный объем должен быть постепенно уменьшен на 1 мл/кг до минимума в 4 мл/кг. Вентиляция с этим дыхательным объемом, как правило, хорошо переносится. У некоторых пациентов может иметь место несинхронность спонтанной и искусственной вентиляции или значимая несинхронность с вентилятором. Как правило, для решения этих проблем достаточно увеличения скорости инспираторного потока и, если необходимо, уровня седации. Несколько исследований показали, что обычно у пациентов, получающих низкий дыхательный объем, не требуется увеличения дозы или продолжительности седативных средств по сравнению с пациентами, которым проводится вентиляция с высоким дыхательным объемом. Респираторный ацидоз может быть, но обычно не является бессимптомным. Увеличение частоты дыхания обычно является достаточным для компенсации сниженного дыхательного объема; в клиническом исследовании частота повышалась до 35. При любом режиме вентиляции при ОРДС иногда пациентам требуется нервно-мышечная блокада для устранения выраженной несинхронности. Хотя многие считают, что миорелаксация должна быть методом второго ряда у пациентов с тяжелой гипоксемией, так как использование мышечных релаксантов может привести к развитию полинейропатии и миопатии критического состояния, одно рандомизированное клиническое исследование показало 28-дневное снижение летальности при использовании нервно-мышечной блокады цисатракуриумбезилатом в течение первых 48 ч при тяжелом ОРДС (PaO2/FiO2 < 150).
В протоколе ARDS Network уровни PEEP и FiO2 титруются в соответствии с набором заранее определенных значений. Оптимальный уровень PEEP при ОРДС является спорным. Высокие уровни PEEP могут быть полезными для предотвращения коллапса альвеол и минимизации повреждения альвеол при их повторяющемся открытии и закрытии. С другой стороны, высокое PEEP может быть избыточным и повредить больше областей легкого. В нескольких исследованиях изучалось влияние различных уровней ПДКВ у пациентов с ОРДС. Крупное многоцентровое исследование, проведенное ARDS Network, рандомизировало пациентов с ОРДС, вентилируемыми с низким дыхательным объемом с невысоким уровнем PEEP (средний уровень PEEP на 1-4 день был равен 8,3 ± 3,2) по сравнению высоким уровнем PEEP (средний уровень PEEP на 1-4 день составлял 13,2 ± 3,5). В этом исследовании не было различий между группами в клинических исходах, включая дни свободные от вентилятора и летальность. Два других исследования по оценке эффектов PEEP при ОРДС дали сходные результаты, хотя в одном из исследований было показано увеличение числа дней, свободных от вентилятора, и дней без органной недостаточности при применении высокого PEEP149. Ни в одном из этих исследований не было показано значительного увеличения частоты баротравм, связанных с высокими уровнями PEEP. Хотя эти три больших исследования не показали положительных эффектов высокого PEEP у всех пациентов с ОРДС, есть подгруппа пациентов, которые могут «выиграть» от высокого PEEP. В небольшом исследовании респираторная стратегия, которая включала низкий дыхательный объем и титрование уровня PEEP выше нижней точки перегиба на кривой объем-давление у каждого отдельного пациента, снижала летальность при ОРДС. Однако оценка кривой объем-давления у каждого пациента не используется рутинно в клинической практике. Учитывая отсутствие убедительных данных о преимуществах высокого PEEP, либо низкого PEEP, текущие рекомендации состоят в том, чтобы скорректировать PEEP в приемлемом диапазоне для достижения адекватной оксигенации при заданной FiO2.
Прон-позиция
Прон-позиция первоначально изучалась в нескольких небольших и трех больших исследованиях, в которых было показано улучшение оксигенации, но не снижение летальности. Анализ подгрупп показал потенциальное преимущество при тяжелом ОРДС, что послужило поводом к проведению многоцентрового проспективного рандомизированного исследования по длительной прон-позиции (> 16 ч/сут) у пациентов с тяжелым ОРДС (PaO2/FiO2 < 150), показавшее значительное снижение 28-дневной летальности в группе с прон-позицией. С учетом результатов этого исследования положение лежа на животе должно использоваться у всех пациентов с тяжелым ОРДС, у которых нет противопоказаний к прон-позиции, таких как повышенное внутричерепное давление, тяжелое кровохарканье, недавно проведенная операция на грудине, беременность, вновь выявленный тромбоз глубоких вен или наличие нестабильных переломов.
Неинвазивная вентиляция и высокопоточная оксигенация через назальные канюли
Неинвазивная вентиляция с положительным давлением (НВПД), полученная с помощью назальной или полной лицевой маски, является эффективной методикой, позволяющей избежать интубации у пациентов с обострением ХОБЛ. Неинвазивная вентиляция обычно используется у детей с ОРДС, хотя имеется только одно небольшое рандомизированное исследование на 50 пациентах, показавшее, что НВПД улучшает оксигенацию и предотвращает необходимость эндотрахеальной интубации у детей, госпитализированных с острой дыхательной недостаточностью. Роль НВПД у взрослых с ОРДС остается неясной. Все большее число небольших исследований указывают на то, что двухуровневая НВПД на основе вентиляции поддержкой давления и ПДКВ может уменьшать потребность в интубации и улучшить результаты лечения у некоторых пациентов с ОРДС. Однако данные больших рандомизированных контролируемых исследований все еще отсутствуют. Более того, представляется вероятным, что большинство пациентов с ОРДС все равно потребует инвазивной механической вентиляции легких. В одном крупном многоцентровом исследовании 354 на 2770 пациентах с острой гипоксемической дыхательной недостаточностью, которые еще не были интубированы, показано, что у 30% пациентов НВЛ оказалась неэффективной, но у 51 % пациентов был не ОРДС. Одна группа пациентов, у которых НВПД особенно привлекательна для использования — это пациенты, имеющие иммуносупрессию по различным причинам, которые подвергаются наибольшему риску развития нозокомиальной инфекции. Обнадеживающие результаты в настоящее время получены у различных пациентов с острой дыхательной недостаточностью и иммуносупрессией.
Совсем недавно была опробована доставка кислорода с высокопоточная оксигенация через назальные канюли у пациентов с острой гипоксемической дыхательной недостаточностью в качестве альтернативы немедленной интубации. В исследовании на 310 пациентах с острой дыхательной недостаточностью, включая некоторых пациентов с ОРДС, показано, что лечение с помощью высокопоточной оксигенации увеличивало число дней свободных от вентилятора и уменьшало летальность по сравнению с неинвазивной или инвазивной механической вентиляцией. Одно преимущество высокопоточной оксигенации через носовые канюли состоит в том, что она может обеспечить значительный уровень PEEP неинвазивно. Ожидаемые данные от более ранних рандомизированных клинических исследований — неинвазивная вентиляции легких или высокопоточная оксигенация через носовые канюли катетеризации носовых канюлей может быть использованы у пациента с ОРДС, у которого нет тяжелого нарушения оксигенации, нестабильности гемодинамики или изменения психического статуса, пока пациент может тщательно соблюдать инструкции и быть легко интубирован, если это необходимо.
Фармакологическая терапия
Специфической фармакологической терапии ОРДС не существует. В больших рандомизированных исследованиях были изучены различные стратегии лечения, включая противовоспалительные стратегии, замещение сурфактанта, вазодилататоры, новые антикоагулянты, антиоксиданты и стратегии для коррекции отека легких. Лекарства, которые оказались перспективными в экспериментальных и ранних клинических исследованиях, но не прошли в больших рандомизированных исследованиях, включают ранее применение:
- глюкокортикоидов,
- фрагменты антител анти-TNF,
- алпростадил,
- сурфактант,
- кетоконазол,
- N-ацетилцистеин,
- процистеин,
- лизофиллин,
- статины,
- албутерол,
- рекомбинантный активированный протеин С,
- инактивированный рекомбинантный фактор VIIa.
Некоторые исследователи предположили, что терапия глюкокортикоидами, хотя и не является полезной для острой фазы ОРДС, может ускорить разрешение позднего фибропролиферативного ОРДС. Одно очень маленькое рандомизированное исследование (из-за наличия перекрестной рандомизации только 4 пациента оставалось в группе плацебо) предполагало, что терапия глюкокортикоидами может быть полезной при позднем ОРДС. Этот вопрос рассматривался в рандомизированном многоцентровом исследовании, проведенном ARDS Network по применению в течение 14 дней метилпреднизолона у пациентов, кто имел ОРДС в течение 7 дней. По сравнению с пациентами, получавшими плацебо, у тех, кто получал метилпреднизолон, наблюдалось увеличение количества дней без шока и дней свободных от вентилятора к 28 дню, а также улучшение оксигенации, но не было увеличения выживаемости, и эти пациенты имели более высокую частоту реинтубации, возможно, из-за нервно-мышечной слабости. Учитывая серьезную озабоченность по поводу безопасности больших доз глюкокортикоидов у пациентов в критическом состоянии, включая возможность повышения риска внутрибольничных инфекций или полинейропатии/миопатии критического состояния и отсутствия снижение летальности, рутинное использование глюкокортикоидов рекомендовать нельзя.
До настоящего времени, несмотря на отрицательные результаты многочисленных исследований фармакологической терапии ОРДС, новые терапевтические стратегии находятся в стадии исследования и могут быть эффективными. Из-за неудачи фармакологической терапии при установленном ОРДС, внимание было обращено на профилактику и раннее лечение ОРДС, и несколько исследований находятся на стадии планирования или уже проводятся. В настоящее время, для установленного ОРДС, во 2-й фазе клинического исследования проводится оценка клеточной терапии на основе внутривенного мезенхимальных стволовых клеток (МСК). В доклинических исследованиях МСК обладают плейотропным защитным и репаративным действием на легкие, включая секрецию противовоспалительных и антибактериальных факторов, секрецию эпителиальных и эндотелиальных факторов роста и прямой перенос их митохондрии для восстановления энергетического баланса в поврежденном легочном эпителии. Еще одна область под активным изучением включает в себя стратегии ускорения разрешения ОРДС. Такие методы лечения могут быть направлены на увеличение скорости клиренса альвеолярной жидкости, модуляцию восстановления эпителия альвеол или модуляцию иммунной регуляции разрешения воспаления.
Неотложная терапия
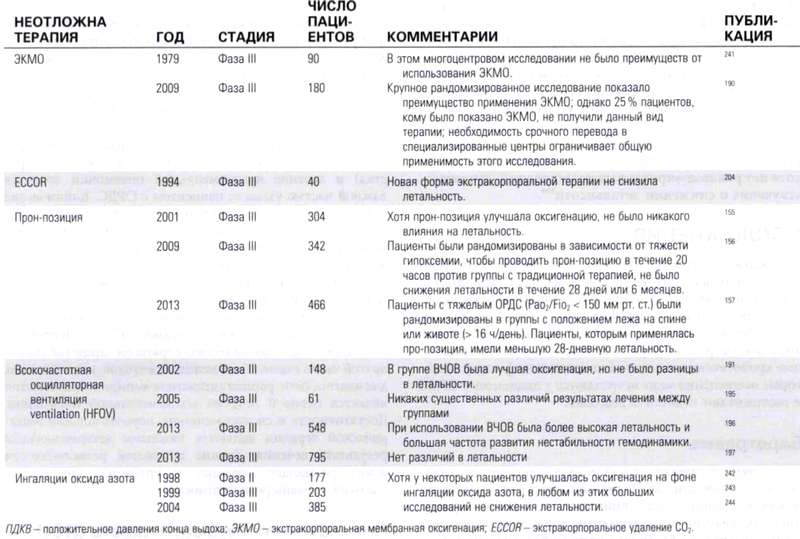
Несмотря на надлежащее лечение, у части пациентов с ОРДС будет иметь место тяжелая и рефрактерная гипоксемия. Стартовое лечение этих пациентов включает глубокую седацию и миорелаксацию для поддержания адекватной оксигенации. У пациентов, которые не реагируют на традиционное лечение с механической вентиляцией с низкими дыхательными объемами и с персистирующей гипоксемией, существует несколько недоказанных методов неотложной помощи, с помощью которых можно попытаться улучшить оксигенацию в остром периоде. Хотя ранее прон-позиция рассматривалась прежде всего как неотложная терапия, в одном исследовании было показано, что прон-позиция снижала летальность при умеренно тяжелом ОРДС; и в настоящее время более часто используется рутинно пациентов с умеренно тяжелым ОРДС (PaO2/FiO2 < 150) как дополнительный метод для улучшения оксигенации в условиях рефрактерной гипоксемии.
Экстракорпоральная мембранная оксигенация (ЭКМО)
Экстракорпоральная мембранная оксигенация (ЭКМО) применяется у пациентов с ОРДС и тяжелой гипоксемией. В специализированных центрах ЭКМО успешно используется для лечения пациентов с тяжелым ОРДС. В одном крупном исследовании по сравнению ЭКМО и традиционного лечения, в котором участвовали 180 пациентов с тяжелым ОРДС, было отмечено улучшение выживаемости без инвалидности через 6 месяцев у пациентов, получавших ЕСМО. В этом исследовании пациенты, рандомизированные в группу с ЭКМО, переводились в специализированный центр для проведения сеансов. По прибытии в специализированный центр только 75% пациентам этой группы фактически имплантировали ЭКМО. Дизайн этого исследования затрудняет определение того, что перевод в специализированный центр для дальнейшего лечения или собственно процедура ЭКМО приносили пользу. Хотя результаты исследования обнадеживают, необходимость перевода в специализированный центр и доля отсева в 25 % после перевода ограничивают универсальность этого исследования; в настоящее время проводятся дополнительные клинические исследования.
Высокочастотная осцилляторная вентиляция (ВЧОВ, HFOV)
Высокочастотная осцилляторная вентиляция (ВЧОВ) оказалась многообещающей в неотложной терапии, в нескольких небольших рандомизированных исследованиях у пациентов с ОРДС было показано улучшение оксигенации у пациентов с тяжелой гипоксемией. Тем не менее два больших рандомизированных клинических исследования при тяжелом ОРДС не продемонстрировали ее преимущества, а в одном из исследований летальность была выше в группе HFOV. По этой причине ВЧОВ следует использовать только в качестве неотложной терапии и только опытными специалистами. Другие виды неотложной терапии включают использование легочных вазодилататоров, таких как ингаляции оксида азота (NO) или ингаляции простациклина.
Ингаляции NO и простациклина
При ОРДС было проведено несколько небольших рандомизированных клинических исследований ингаляций NO; хотя ни в одном из них не наблюдалось снижения летальности, его использование приводило к улучшению оксигенации. Ингаляционный простациклин является другим легочным вазодилататором, который может использоваться в качестве неотложной терапии при тяжелом рефрактерном ОРДС, хотя нет рандомизированных исследований, свидетельствующих о снижении летальности.
Осложнения
Баротравма
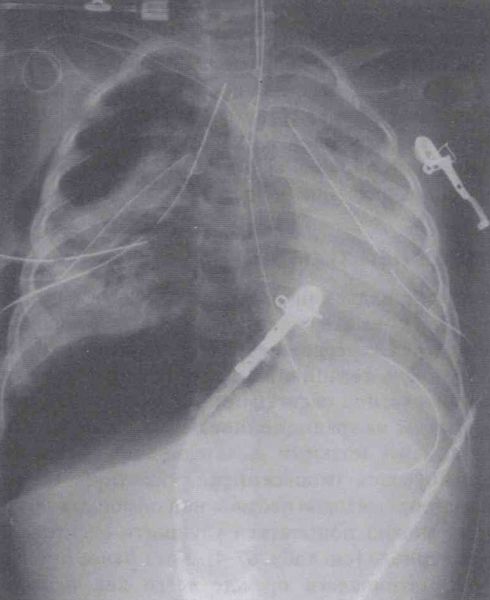
Баротравма возникает, когда воздух попадает из дыхательных путей или альвеолярного пространства в окружающие ткани, что приводит к пневмотораксу, пневмомедиастинуму, пневматозу яичек или подкожной эмфиземе. Точная частота баротравмы легких при ОРДС неясна, но, по-видимому, снижается со временем. Данные двух крупных рандомизированных исследований по протективной вентиляции позволяют предположить возникновение раннего пневмоторакса в 12-13% случаев. Ранее сообщалось о более высокой частоте, что, возможно, было результатом использования механической вентиляции легких с большими и дыхательными объемами и очень высоким давлением плато на вдохе. Из 861 пациента, участвовавших в исследовании NIH ARDS Network, приблизительно 10% имели какую-либо форму баротравмы, независимо от того, применялся ли дыхательный объем, равный 6 или 12 мл/кг. Кроме того, уровень PEEP был единственным фактором, который предсказывал развитие баротравмы в при многофакторном анализе.
Лечение баротравмы зависит от места расположения экстраальвеолярного воздуха. Пневмоторакс может быть опасным для жизни, особенно если он напряженный; необходимо проведение немедленной диагностики и дренирования плевральной полости. Развитие пневмоторакса следует предполагать у любого пациента, которому проводится механическая вентиляция по поводу ОРДС, у которого развивается внезапное, необъяснимое нарастание гипоксемии, респираторного дистресса или нестабильности гемодинамики. Для постановки диагноза обычно достаточно рентгенограммы грудной клетки (предпочтительно вертикальной), но во многих случаях может не хватить времени на ее получение. Пневмомедиастинум и подкожная эмфизема могут вызвать боль, но не требуют специальной терапии, кроме анальгезии. Воздушный эмбол представляет собой потенциально фатальное осложнение механической вентиляции с положительным давлением, которое время от времени возникает у пациентов с ОРДС, обычно в сочетании с другими признаками доказательствами баротравмы легких, часто одновременно.
Нозокомиальная пневмония
Частоту случаев возникновения нозокомиальной пневмонии у пациентов с ОРДС трудно оценить количественно. В зависимости от диагностических критериев и/или используемой стратегии оценки, частота варьирует от 15 до 60 %. Консенсуса относительно соответствующего способа диагностики нозокомиальной пневмонии у пациентов, которым проводится механическая вентиляция, нет. Поскольку пациенты с ОРДС часто умирают от неконтролируемой инфекции, диагностика (хотя и особенно непростая) и лечение нозокомиальной пневмонии является важной частью ухода за пациентом с ОРДС. Клинические критерии, обычно используемые для диагностики нозокомиальной пневмонии, включают лихорадку, повышение количества лейкоцитов, гнойная мокрота и инфильтраты в легких. Однако эти признаки часто присутствуют у пациентов с ОРДС даже при отсутствии нозокомиальной пневмонии. Аутопсийные исследования у пациентов, умерших от ОРДС, свидетельствуют о высокой частоте возникновения недиагносцированной пневмонии. Подробное обсуждение диагностических стратегий представлено в другой части главы. Независимо от методов, используемых для диагностики, ранняя адекватная эмпирическая терапия является основой лечения нозокомиальной пневмонии. Достаточность и своевременность первоначальной эмпирической терапии являются важными детерминантами результата лечения. Знание локальной резистентности имеет решающее значение, и требуется заподозрить высокий уровень резистентности.
Полиорганная недостаточность (ПОН)
Хотя ОРДС часто считают первичным легочным расстройством, ОРДС часто представляет собой системное расстройство с большим сходством с сепсисом или ССВР.
ПОН является распространенным осложнением при ОРДС. Дисфункция органов может быть следствием основной причины ОРДС, такой как сепсис, или возникать независимо. Истинную частоту ПОН при ОРДС трудно оценить количественно. В исследовании ARDS Network, посвященном вентиляции малым дыхательным объемом, среднее количество повреждений систем, кроме легких, на одного пациента составило 1,8. Учитывая одновременное возникновение множественных повреждений органов, часто бывает трудно определить точную причину смерти у пациентов с ОРДС, а выживание в конечном итоге зависит от успешной поддержки отказавших органов.
Нервно-мышечная слабость
Пациенты с ОРДС подвержены высокому риску развития длительной мышечной слабости, которая сохраняется после разрешения легочных инфильтратов и может осложнить отмену механической вентиляции легких и реабилитацию. Этот клинический синдром обычно называют полинейропатией критического состояния, но он имеет компоненты нейропатии и миопатии, которые могут сосуществовать или встречаться отдельно. Хотя имеются небольшие проспективные данные, некоторые исследования показывают, что нервно-мышечные аномалии сохраняются у многих выживших после критического состояния, даже когда они повторно обследовались через 5 лет после выписки из ОРИТ. Длительная мышечная слабость наиболее часто встречается у пациентов в критическом состоянии, которые получали глюкокортикоиды. В одном исследовании было показано, что использование кортикостероидов является наилучшим независимым предиктором невозможности перевода из ОРИТ. При отсутствии убедительных клинических показаний, таких как системные заболевания соединительной ткани, использование глюкокортикоидов не должно быть рутинным, пока не появятся новые клинические данные в подтверждение их клинической пользы при ОРДС. В других исследованиях была также отмечена нервно-мышечная блокада.
Клинические исходы и прогноз
По сообщениям, летальность при ОРДС постепенно снижается, хотя этот результат не был последовательным в ретроспективных исследованиях. До 1990-х годов летальность по данным клинических исследований была примерно от 40 до 60 %. В нескольких недавно проведенных одноцентровых исследованиях было показано, что показатели летальности, оцененные в тех же центрах, со временем снизились. В исследовании ARDS Network, в котором участвовали 861 пациент с ОРДС в конце 1990-х годов, суммарная летальность при выписке из стационара составила 31% в группе с дыхательным объемом 6 мл/кг и 40% в группе с дыхательным объемом 12 мл/кг. Однако данные о летальности данного исследовании могут значительно недооценить общую летальность от ОРДС, поскольку многие пациенты в критическом состоянии были исключены, в том числе с тяжелыми заболеваниями печени, трансплантацией костного мозга, тяжелыми хроническими заболеваниями легких, ожогами более 30% поверхности тела или любой другой патологии с вероятностью смерти более 50% случаев в течение 6 месяцев. Как было отмечено в других исследованиях, риск госпитальной летальности в этом исследовании был самым высоким у пациентов с сепсисом (43%), у лиц с пневмонией (36%) и аспирацией (37%), а также у пациентов с сочетанной травмой (11%). Стратегия низких дыхательных объемов была эффективной для снижения летальности при всех причинах ОРДС. Другое исследование ARDS Network показало, что реализация стратегии низких дыхательных объемов связана с более низкой летальностью в больницах по сравнению с контрольными данными за прошлые годы. В более позднем исследовании ARDS Network, опубликованном в 2012 году, общая летальность за 60 дней составила 23 %.
В нескольких недавних многоцентровых исследованиях во Франции, Швеции, Австралии и Аргентине была предпринята попытка определить показатели летальности и ее прогностические факторы в обсервационных исследованиях, основанных на популяциях, а не на клинических данных. В этих исследованиях летальность была различной — от 32% при легком ОРДС до 58-60% при умеренном и тяжелом ОРДС. Факторы, независимо связанные с летальностью при ОРДС, варьировали от исследования к исследованию и включали в себя возраст, оценку по шкалам физиологических данных, отношение PaO2/FiO2, органные нарушения или септический шок, иммуносупрессию, сердечно-сосудистую недостаточность и хроническое заболевание печени. Два других американских исследования пациентов с ОРДС, преимущественно из терапевтических ОРИТ, сообщили о высокой общей летальности (58 %). Летальность была связана с хроническими заболеваниями печени и другими основными заболеваниями, такими как ВИЧ-инфекция или рак. Хотя в большинстве исследований сообщается о летальности от ОРДС в короткие сроки, в недавнем исследовании была изучена одногодичная летальность. В гетерогенной группе из 641 пациентов с ОРДС летальность в течение одного года была значительно выше, чем госпитальная летальность (41 против 24%; Р < 0,0001). Таким образом, эти исследования показывают, что хотя некоторое снижение летальности от ОРДС было достигнуто, летальность остается довольно высокой в популяционных исследованиях, и улучшение краткосрочных результатов может не отразиться на более долгосрочных результатах.
Выжившие после ОРДС часто имеют длительную функциональную недостаточность, когнитивную дисфункцию и психосоциальные проблемы. Интересно, что у выживших часто наблюдается нормальная или почти нормальная функция легких. В исследовании о наблюдении в течение 1 года у 109 лиц, перенесших ОРДС, объем легких и показатели спирометрии вернулись к норме через 6 месяцев. Тем не менее способность к диффузии углекислого газа в течение года постоянно снижалась. Тест шестиминутной ходьбы был постоянно снижен в течение 12 месяцев, в основном из-за потери мышечной массы и слабости, а не патологии функции легких. Лечение любым системным кортикостероидом, наличие заболевания, приобретенного во время пребывания в ОРИТ, и темп разрешения повреждения легких и полиорганная недостаточность во время пребывания в ОРИТ были наиболее важными факторами, определяющими результаты теста шестиминутной ходьбы в течение первого года наблюдения. Сообщается, что в других исследованиях у пациентов, переживших ОРДС, снижается связанное со здоровьем качество жизни и связанное со здоровьем легких качество жизни и имеются функциональные нарушения, которые сохраняются через 2 года после выписки из отделения реанимации и интенсивной терапии. В дополнение к физическим имеются социальные трудности после ОРДС, у выживших имеет место высокий уровень депрессии и тревоги.