Содержание
Ванкомицин был открыт в 1956 году и уже в 1958 году появился на рынке. Ранние партии ванкомицииа содержали пирогены и примеси, которые создавали коричневатый, мутный вид, давшие ванкомицину название «Миссисипи-грязь». Кроме того, эти пирогены и примеси вызывали лихорадку, артериальную гипотонию, тяжелый флебит и, возможно, нефротоксичность.
Инструкция к ванкомицину
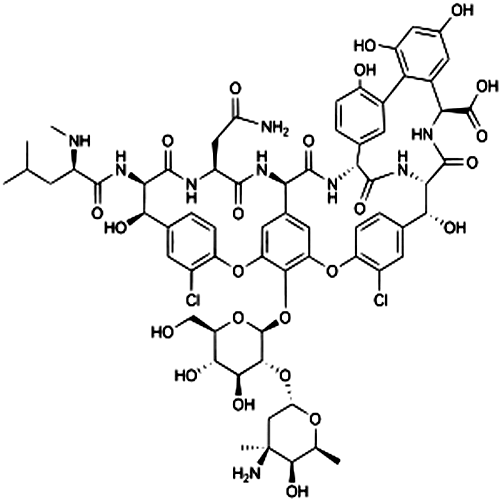
Механизмы действия ванкомицина и резистентность
Ванкомицин является гликопептидным антибиотиком, обладающим бактерицидной активностью против большинства грамположительных микроорганизмов, который угнетает синтез клеточной стенки путем присоединения прекурсора d-аланил-d-аланина к клеточной стенке. В последнее десятилетие лаборатория Института клинических стандартов (CLSI) и FDA изменили диагностические точки определения чувствительности к ванкомицину для S. aureus — по минимально подавляющей концентрации (МПК) от 4 мкг/мл к менее или равной 2 ,мкг/мл для чувствительных штаммов. Промежуточная чувствительность в настоящее время характеризуется величиной от 4 до 8 мкг/мл, а устойчивость — равной или превышающей значение в 16 мкг/мл. The European Committee on Antimicrobial Susceptibility Testing (EUCAST) изменил эту интерпретацию теста, установив другие значения против S. aureus: менее или равную 2 мкг/мл для определения чувствительных штаммов и более 2 мкг/мл для резистентных. Эти изменения в контрольных точках определения чувствительности стали влиять на интерпретацию в литературе распространенности ванкомицин-промежуточного (VISA) или ванкомицин-резистентного (VRSA) S. aureus за последние 30 лет.
Пять типов резистентности к энтерококкам были установлены у ванкомицина: VanA, VanB, VanC, VanD и Van E. Фенотип VanA, индуцированный ванкомицином, характеризуется высоким уровнем устойчивости к обоим гликопептидам: тейкопланину (МПК 16-512 мкг/мл) и ванкомицину (от 64 и более, чем 1000 мкг/мл), тогда как VanB обладает более низким уровнем резистентности, характерным преимущественно к ванкомицину. Оба типа устойчивости были идентифицировны у Enterococcus faeceum и Enterococcus faecalis. Фенотипы VanA, В, D, Е оказались трансферабельными к другим микроорганизмам. В отличие от этих фенотипов VanС имеют эндогенный характер происхождения и являются структурными компонентами штаммов Enterococcus gallinarum, Enterococcus casseliflavus и Enterococcus flavescens, они самостоятельно придают им устойчивость к ванкомицину.
Первое наблюдение в отношении появления vancomycin-intermediate штаммов S. aureus (VISA), определяемого по МПК с 8 до 16 мкг/мл, было сделано в 1996 году в Японии. В июне 2002 из США поступило сообщение о выделении восьми подобных штаммов. Предшественник VISA, известный как гетерорезистентный vancomycin-intermediate S. aureus (hVISA), был описан примерно в это же время. Используя новые определения чувствительности, наблюдение, проводимое в 42 медицинских центрах США в 2011 году, показало повышение распространенности hVISA по сравнению с 2009 годом (1,2 % против 0,4 %), но штаммы VISA не были обнаружены.
В июне 2002 года первый vancomycin-resistant S. aureus (МПК более 32 мкг/мл) был идентифицирован в Мичигане, а в последующем — в сентябре в Пенсильвании. В то время как точный механизм, ведущий к снижении чувствительности изолятов VISA, до сих пор не определен, многие исследователи сходятся во мнении, что общий элемент устойчивости включает утолщение клеточной стенки. Кроме того, оба штамма ванкомицин-резистентного золотистого стафилококка были носителями гена VanА.
Спектр активности

Ванкомицин, прежде всего, активен в отношении аэробных грампозитивных кокков, включая Corynebacterium и MRSA. МПК90 составляла 1 мкг/мл для methicillin-susceptible S. aureus (MSSA) и от 1 до 2 мкг/мл для MRSA. В целом, настоящая распространенность VISA и vancomycin-resistant S. aureus (VRSA) очень низкая. Активность ванкомицииа в отношении энтерококков сильно варьирует у различных видов. Е. faecium является наиболее резистентным микроорганизмом среди энтерококков к ванкомицину. Устойчивость к нему зависит от конкретного лечебного учреждения и варьирует в пределах от 30 до 90%. Для всех энтерококков она составляет в среднем около 35 %. Большинство стрептококков чувствительны к ванкомицину, однако он рассматривается как средство последней линии против данных микроорганизмов. Ванкомицин показал меньшую клиническую эффективность, чем нафциллин и оксациллин в лечении инфекций, связанных с MSSA. Большая частота клинических неудач, длительность терапии и более высокая смертность была показана при использовании ванкомицина, именно, в сравнении с нафциллином и оксациллином. Ванкомицин также активен против грампозитивных анаэробов, таких как Peptostreptococcus spp., Propionibacterium spp., Eubacterium spp., Bifidobacterium spp., большинства штаммов Clostridium spp., включая C. difficile.
Фармакокинетака/фармакодинамика
Ванкомицин может быть назначен перорально или внутривенно. Препарат плохо всасывается после перорального приема, и в то время, как его большая часть выводится в неизмененном виде с калом, воспалительный процесс в желудочно-кишечном тракте может привести к увеличению всасывания. Его внутримышечные инъекции являются крайне болезненными и не должны использоваться. Около 55 % введенного ванкомицина связывается с белками плазмы. Объем распределения (Vd) корректированный для диапазонов массы тела составляет от 0,4 до 0,9 л/кг. Ванкомицин не проникает через не воспаленные оболочки мозга. Однако при развитии их воспаления уровень пенетрации варьирует от 1 до 37% от концентрации в сыворотке крови. Проникновение в асцитическую, перикардиальную и синовиальную жидкость превышает 75% от содержания в сыворотке, примерно 50% попадает в плевральную жидкости и от 30 до 50 % — в желчь. От 80 до 90% ванкомицина элиминируется с мочой в неизмененном виде посредством клубочковой фильтрации, остальное количество посредством внепочечного выведения. Период полувыведения препарата увеличивается при снижении функции почек к у пациентов с клиренсом креатинина более 80 мл/мин составляет от 4 до 6 часов. Для прогнозирования эффективности с позиций фармакодинамики большое внимание уделяется расчету площади под кривой концентрация (ППК) время в качестве оптимального соотношения ППК/МПК предлагается значение 400.
Дозы ванкомицина
Таблетки
Пероральный прием ванкомицина в таблетках рекомендуется только для терапии С. difficile колита. Разовая доза варьирует от 125 до 500 мг каждые 6 часов вне зависимости от функции почек, что связано с его плохой абсорбцией из желудочно-кишечного тракта, В этом случае могут быть использованы капсулы или раствор препарата, предназначенный для внутривенного введения (табл. 117-1).
Внутривенное введение ванкомицина у взрослых
У взрослых пациентов без излишней массы тела и нормальной функцией почек обычная доза ванкомицина составляет 1 грамм (около 15 мг/кг) каждые 12 часов. Эта доза создает пиковую концентрацию препарата от 25 до 40 мкг/мл после завершения инфузии и через 1 час после нее его содержание в плазме крови сохраняется в пределах 5-15 мкг/мл. Для более точного режима дозирования ванкомицина были разработаны ряд подходов. Самые популярные из них методы включают использование номограмм Moellering и Matzke. Эти методы, позволяющие рассчитать дозу ванкомицина, принимают во внимание вес тела и клиренс креатинина (CrCl). Недостатки этих номограмм заключаются в небольшом количестве больных, используемых при их создании, и фиксированный объем распределения, составляющий для всех пациентов 0,9 л/кг. Между тем, существует разница в объеме распределения препарата (0,4-0,9 л/кг), что влияет на воспроизводимость этих номограмм при их применении для различных групп пациентов. Стандартные и модифицированные формулы Кокрофта и Голта в оценке клиренса креатинина (CrCl) являются относительно надежными и точными у больных с нормальной массой тела .
Дозы ванкомицина при ожирении
У пациентов с морбидным ожирением в связи с отсутствием фармакокинетических исследований подбирать оптимальную дозу представляется затруднительным. Основываясь на недавних исследованиях, фактическая масса тела и клиренс креатинина лучше всего коррелируют с объемом распределения и клиренсом креатинина. Дополнительным способом оценки клиренса креатинина может быть метод Салазар-Коркоран. Разброс уровня ванкомицина в плазме крови у молодых больных без сопутствующей патологии может быть в 2,3-2,5 раза выше, по сравнению с пациентами без ожирения, что требует более частого изменения режима дозирования для достижения оптимального содержания в крови сывороточной концентрации 5-15 мкг/мл. С другой стороны, существует риск передозировки ванкомицина у тучных пациентов пожилого возраста из-за снижения функции почек.
Дозы ванкомицина при критических состояниях
Определение соответствующей дозировки ванкомицина у тяжелобольных пациентов может быть сложным из-за изменений в объеме распределения и почечного клиренса. Как было показано в многоцентровом проспективном исследовании, фармакокинетические параметры при соблюдении современных режимов дозирования могут существенно различаться. В целом, среднее значение содержания ванкомицина в плазме крови составляло 17 мкг/мл (диапазон 8-23), и у 57,1 % пациентов оно было больше или равно 15 мкг/мл. Другое исследование с включением пациентов с тяжестью ПОН по шкале SOFA более или равной 11 баллов, ожирением и нестабильной функцией почек обнаружило у них меньшую предиктивную возможность при проведении фармакокинетического моделирования. Эти исследования показывают высокую изменчивость фармакокинетики ванкомицина у тяжелобольных пациентов и необходимость подбора индивидуального режима дозирования.
Дозы ванкомицина при почечной недостаточности и гемодиализе
Выведение ванкомицина было изучено во время процедуры гемодиализа на трех типах целлюлозных мембран со средним уровнем элиминации от 13 до 24 и 26% на мембранах с высокой производительностью (ЕКН210) и триацетатом целлюлозы (СТ). На синтетических мембранах высокого потока из полисульфона или полиакрилонитрила доля удаленного ванкомицина оказалось значительной большей, чем на целлюлозных мембранах — от 40 до 55%, соответственно. Из наиболее часто используемых методов непрерывной заместительной почечной терапии (ЗПТ): постоянный вено-венозный гемодиализ (ПВВГД) и постоянный артериовенозный гемодиализ (ПАВГД), последний обеспечивает более высокий клиренс ванкомицина, чем ПВВГД. Общий клиренс ванкомицина при проведении ПВВГД или ПАВГД составляет 31-39 мл/мин. Высокообъемная гемофильтрация (ВОГФ) увеличивает клиренс ванкомицина примерно до 60 мл/мин. Таким образом, пациенты, находящиеся на ПАВГД или ПВВГД, должны получать ванкомиции каждые 36-48 часов, а при проведении ВОГФ — каждые 12-24 часа.
Дозирование у пациентов, получающих расширенный ежедневный диализ в сочетании с прерывистым гемодиализом или другими вариантами почечной заместительной терапии (ПЗТ), является гораздо более сложным, в силу скудности данных, которые существуют по этой проблеме. В целом, обзор нескольких фармакокинетических исследований у пациентов, получающих различные виды ЗПТ, показал связь между скоростью потока эффлюента и клиренсом ванкомицина. Однако эти выводы требуют дополнительной валидации. Основываясь на вариабельности клиренсовых характеристик, зависящих от скорости кровотока, темпа ультрафильтрации, используемых мембран, терапевтический лекарственный мониторинг остается в настоящее время наиболее оптимальным способом дозирования ванкомицина при проведении пролонгированной ЗПТ.
Дозы ванкомицина при проведении искусственного кровообращения и экстракорпоральной мембранной оксигенации
Как показано в нескольких небольших исследованиях, проведенных за последние 20 лет, искусственное кровообращение (ИК) значительно изменяет фармакокинетические параметры ванкомицина. Так, например, Ortega и соавторами наблюдали немедленное снижение плазменной концентрации ванкомицина на 7 мкг/мл после подключения ИК с последующим дальнейшим постепенным снижением в течение 30 минут. Однако недавнее проспективное, сравнительное исследование оценки фармакокинетики ванкомицина не обнаружило разницы в максимальной плазменной концентрации (Сmax), площади под кривой (AUC0-8) объемом распределения (Vd) и клиренсом креатинина (Cl) между пациентами, перенесшими кардиохирургические операции с ИК и без него. В исследовании, где 11 пациентам проводили экстракорпоральную мембранную оксигенацию (ЭКМО) и непрерывную инфузию ванкомицина, обнаружили, что средний объем распределения и клиренс были аналогичны параметрам контрольной группы, отражением чего была относительная стабильность содержания ванкомицина в ЭКМО-контуре.
Терапевтический лекарственный мониторинг при приеме ванкомицина
Рутинный мониторинг концентрации ванкомицина в сыворотке крови с годами стал весьма обсуждаемой темой. Те, кто выступает за его проведение, ссылаются на необходимость обеспечения терапевтических концентраций, а также минимизацию токсичности. Однако выполненные исследования показали, что пиковые концентрации ванкомицина не связаны с токсичностью или клинической эффективностью. Таким образом, мониторинг пиковой концентрации в сыворотке крови не приносит клинической пользы. С другой стороны, мониторинг концентрации ванкомицина был хорошо изучен для определения корреляции с эффективностью и токсичностью. Несколько недавних публикаций обнаружили улучшения результатов при удержании концентрации ванкомицина в пределах 15-20 мкг/мл. В отличие от этого было показано, что поддержание концентрации ванкомицина в крови на уровне более или равной 15 мкг/мл связано с повышенным риском нефротоксичности. Учитывая отсутствие единой позиции, может быть разумным использование измерения концентрации в сыворотке крови до тех пор, пока на основании дальнейших исследований не будут сформулированы окончательные рекомендации.
Побочные эффекты ванкомицина
Нежелательные лекарственные явления (НЛЯ), которые были связаны с введением ванкомицина, включают в себя синдром красного человека, тромбофлебит, ототоксичность и нефротоксичность. Доказательства, установления четкой взаимосвязи между этими проявлениями токсичности и пиковой концентрации ванкомицина или распространенностью этих явлений ограничены или противоречивы. Синдром красного человека, включая эритему, зуд и гиперемию верхней части туловища, часто ассоциирует со слишком быстрым вливанием препарата. В общем, скорость инфузии препарата не должна превышать 1 г/час. При такой скорости введения снижается риск развития артериальной гипотонии и отека Квинке, Считается, что причиной этого синдрома является увеличение освобождения гистамина, эффекты которого могут быть ограничены введением антигистаминных препаратов. Частота проявлений ототоксичности встречается от 0 до 9% пациентов, получавших ванкомицин. Критерием определения ототоксичности служит появление шума в ушах или потеря слуха. Доказательства взаимосвязи между ототоксичностью и высокой пиковой концентрацией в сыворотке крови ванкомицина ограничены. Сообщения о взаимосвязи пиковых концентраций и ототоксичности касаются содержания ванкомицина в крови в пределах от 37,5 мкг/мл до 152 мкг/мл.
Сравнение одно- и двукратного режима дозирования ванкомицина продемонстрировало более частое развитие ототоксичности при введении препарата два раза в сутки (15,6% против 3,2%), хотя в этих условиях регистрировалась более низкая пиковая концентрация по сравнению с группой, получавшей препарат один раз в день.
Отсутствие корреляции между концентрациями ванкомицина в сыворотке и ототоксичностью свидетельствует о том, что наблюдаемая токсичность была обусловлена другим препаратом или его сочетанием с ванкомицином. В большинстве случаев симптомы ототоксичности исчезали в течение месяца после прекращения терапии ванкомицином.
Вопрос о нефротоксичности, связанной с ванкомицином, трактуется неоднозначно в силу нескольких обстоятельств. Первоначальный состав препарата был очень нечистым, и наличие примесей обуславливало его токсичность, включая нефротоксичность. Кроме того, на протяжении времени были использованы разные определения нефротоксичности, а в различных популяциях пациентов были изучены и разные дозы препарата, что затрудняет сравнивать одно исследование с другим. В общем, представляется, что нефротоксичность ванкомицина составляет от 5 до 10% при условии, что его введение не сочетается с другими агентами, способными повреждать функцию почек и его нижняя граница концентрации в этом случае составляет менее чем 10 мкг/мл.
Elting и соавторы определили в качестве предикторов риска развития нефротоксичности, связанной с ванкомицином, преклонный возраст, индекс по шкале APACHE II более 40 баллов и длительность терапии более 14 дней. В других исследованиях установлены более высокие значения риска нефротоксичности (21-35%), когда содержание ванкомицина в крови превышало 10 мкг/мл. В дополнении к этим данным Lodise продемонстрировал более высокий риск нефротоксичности (~35%), когда общая суточная доза составляла 4 грамма, в сравнении с ее более низкими значениями (11%). Увеличение риска развития нефротоксичности показано при комбинации ванкомицина и аминогликозидов. Goetz в мета-анализе, включившем 8 исследований, обнаружил, что риск нефротоксичности при комбинированной терапии составлял 13%, тогда как при монотерапии — 4%, что выше, чем при терапии аминогликозидами. Другие клинические проявления токсичности, ассоциированные с ванкомицином, включают эритематозные высыпания (2-8 %) и, крайне редко, нейтропению, тромбоцитопению.